Статьи
Опубликовано в:
«ГРИПП
Пособие для врачей, Санкт-Петербург — Харьков, 2007»
Входными воротами для вирусов гриппа является эпителий дыхательных путей. Однако организм человека в течение столетий совершенствовал механизмы защиты и первой их линией являются неспецифические факторы. К ним относятся вязкие свойства слизи, постоянное движение ресничек цилиндрического эпителия, неспецифические ингибиторы репликации вируса, которые содержатся в секрете дыхательных путей, макрофаги, захватывающие вирус, секреторный IgA. Факторами защиты являются также лектины С-типа (конагглютинин, манозосвязывающий белок, белки А и D сурфактанта), которые связываются с углеводами вируса, вызывают его агрегацию, приводя к опсонизирующему действию. Для того чтобы произошло инфицирование, вирус должен побороть факторы неспецифической резистентности дыхательных путей. Главной мишенью вируса являются клетки цилиндрического реснитчатого эпителия.
Переборов сопротивление ослабленных ресничек, возбудитель попадает в носоглотку и поддается действию высокоактивного секрета клеток. Белки секрета слизистых желез способны неспецифически ингибировать гемагглютинирующую и инфекционную активность вируса гриппа. Это действие обусловлено наличием в секрете гликопротеидов, которые содержат значительное количество N-ацетилнейраминовой кислоты. Существуют сезонные колебания содержания ингибиторов. Наиболее активны они в летне-осенний период, а в период эпидемии гриппа (зима) содержание ингибиторов снижается. Погибшие клетки отрываются и захватываются макрофагами, а также удаляются с секретом дыхательных путей. В подслизистом слое в результате высвобождения биологически активных веществ (гистамин, серотонин, кинины, простагландины) возникает реакция сосудов, форменных элементов крови, образование мелких тромбов и кровоизлияний, диапедез мо-нонуклеаров и нейтрофильных лейкоцитов, отек, местные нарушения метаболизма, изменения рН среды в кислую сторону и тому подобное. При этом патологический воспалительный процесс наиболее выражен в трахее и бронхах.
Наличие токсикоза при гриппе является существенной особенностью патогенеза. Симптомы интоксикации являются следствием резорбции токсичных субстанций вирусов, продуктов нарушенного обмена веществ, что прямо или опосредованно влияет на органы и системы. Вирус обладает токсическим действием на сосудистую систему, значительно повышая проницаемость и ломкость сосудов, что в комплексе с расстройствами микроциркуляции может приводить к развитию геморрагического синдрома. В возникновении циркуляторных расстройств, кроме прямого действия на сосудистую стенку, большое значение имеет нейротропность вируса. Характерны фазовые повреждения вегетативной нервной системы, касающиеся двух ее частей (симпатической и парасимпатической): гипертензия изменяется гипотензией, тахикардия — брадикардией, повышается секреция слизи в дыхательных путях, появляется потливость.
Проникая в более глубокие слои эпителия, вирус встречается со второй линией специфической обороны (интерферон, циркулирующие антитела классов IgM, IgG, IgE, температурная реакция). Механизмы иммунного ответа при гриппе представлены на рис. 3.
Рис. 3. Механизмы иммунного ответа при гриппе
При гриппе в ответ на инфицирование развиваются ранние цитокиновые реакции (РЦР) как наиболее быстрый ответ на вирус. Здесь мы имеем дело с естественным (врожденным) и наиболее распространенным вариантом РЦР на вирус гриппа как на внутриклеточного паразита, когда вирус сам включает систему интерферона, играя роль природного индуктора.
Каскад внутриклеточных событий, который наблюдается после внедрения вируса, обусловлен индукцией образования ИФН и в последующем разрушением вирусных информационных РНК, благодаря действию 2′-5′-олигоаденилсинтетазы и активации эндонуклеазы. Параллельно активированная протеинкиназа фосфорилирует а-субъединицу фактора, который инициирует трансляцию, что приводит к блокировке синтеза вирусных белков. Все это приводит к угнетению репродукции широкого спектра РНК и ДНК-содержащих вирусов за счет прямого внутриклеточного антивирусного эффекта. Эти явления происходят в течение первых часов после проникновения вируса гриппа в организм.
Интерфероны (в первую очередь ИФН-b или так называемые интерфероны I типа) имеют способность к активации естественных киллеров (ЕК) и цитотоксических лимфоцитов. В результате на этом этапе вирусного инфицирования локально осуществляются три взаимосвязанных действия:
- внутриклеточная ингибиция интерферонами репродукции вирусов;
- удаление посредством ЕК и ЦТЛ инфицированного материала;
- защита вновь образованным интерфероном окружающих незараженных клеток от возможного заражения.
Интерферон распределяется по организму, связывается со специфическими рецепторами здоровых неповрежденных клеток и делает их невосприимчивыми к вирусу. С интерферонсвязанных неинфицированных клеток вокруг очага вирусной инфекции образуется заслон для последующего распространения инфекции. Кроме того, интерферон активирует почти все иммунные реакции (модуляция взаимосвязи между эндокринной и иммунной системами, активация макрофагов, повышение цитотоксичности, стимуляция экспрессии антигенов ГКГ I и II классов).
Однако описанные эффекты ИФН нередко являются недостаточными для завершения инфекционного процесса. Подобное имеет место при сниженном сопротивлении организма, дефектности системы ИФН и иммунитета, неблагоприятной экологической ситуации, действии стрессов и др.
В итоге развивается острое заболевание, которое сопровождается продукцией каскада ранних цитокинов (второй этап РЦР), активацией CD4+ и CD8+ Е-клеток с последующим развитием специфического, опосредствованного Т- и В-клеточного иммунитета. В этих случаях кроме ИФН 1-го типа синтезируются такие ранние цитокины, как фактор некроза опухоли, образуются интерлейкины (IL) 1b, 6, 10 и 15, а также трансформирующий фактор роста (TGF). На этом этапе уже отмечается вариабельность РЦР при разных вирусных инфекциях. Продукция ИФН-b считается ключевым доминантным признаком инфицирования вирусом.
ИФН а/b вызывает лейкопению, лимфаденопатию, миграцию клеток из красной пульпы селезенки в белую пульпу, то есть происходит перераспределение клеток для последующих иммунорегуляторных эффектов. ИФН а/b могут усилить специфический иммунный ответ при гриппе в период первичной инфекции за счет притягивания популяции В- и Е-клеток в места воспаления для антигенной презентации.
Первыми на инфекцию начинают реагировать макрофаги, в них происходит расщепление вирусной частицы на отдельные пептиды, которые продвигаются к поверхности клетки, здесь (на мембране макрофага) они контактируют с молекулами ГКГ I и II классов. ИФН, который секретируется ИЛ-1, усиливает экспрессию антигена ГКГ. Выраженное синергичное действие ИЛ-1 и ИЛ-2 способствует пролиферации предшественников Т-клеток в вилочковой железе. В очаг инфекции направляются Т-лимфоциты (хелперы), которым и предоставляются фрагменты антигена в комплексе с молекулами ГКГ. В активации Т-хелперов принимают участие ИЛ-4, ИЛ-6 и ФНО. Возможна ситуация, когда Т-лимфоциты способны непосредственно связывать вирусные антигены при участии антигенов II класса ГКГ. Потом подключаются ЦТЛ и NK-клетки, которые являются основными факторами ликвидации инфицированных вирусом клеток. Но роль CD8+ ЦТЛ двойственна: с одной стороны, они более эффективно по сравнению с другими субпопуляциями элиминируют вирус из отделов нижних дыхательных путей, с другой — усиливают реакции локального воспаления, вызывая в эксперименте синдром респираторного дистресс-синдрома. Результатом этого взаимодействия может стать победа вируса, тогда макроорганизм подключает факторы гуморального иммунитета (местного и общего).
Основу специфического местного иммунитета составляет секреторный IgA. В его синтезе принимают участие клетки реснитчатого эпителия, макрофаги, Т-лимфоциты, клетки секреторного эпителия. Макрофаги, локализованные в пространствах между эпителиальными клетками, захватывают обломки разрушенных вирусом клеток, метаболизируют их. Антигены, подготовленные макрофагами, активизируют Т- и В-лимфоциты, которые превращаются в плазмоциты, продуцируют антитела класса IgA. Выполняя важные эффекторные функции, IgA играет роль молекулы, которая регулирует функции клеток иммунной системы, в частности альвеолярных макрофагов, несущих рецепторы к Fc-фрагменту этого Ig. Так, иммунные комплексы, которые содержат антитела класса А, индуцируют в моноцитах-макрофагах синтез ФНО-а и СЗ-комплемента С. Секреторные IgA связывают вирус и препятствуют его выходу из организма в активной форме, что ограничивает циркуляцию вируса среди людей.
При первой встрече с вирусом через 3-5 дней образуются антитела класса IgM. Повышение их содержания свидетельствует об остроте инфекционного процесса. Высокое содержание Ig в крови является показателем устойчивости организма к инфекции. IgE — единственный тип антител, который вступает во взаимодействие с мембраной тучных клеток (в клинической картине наблюдаются приступы бронхоспазма).
Иммунные механизмы при первичной встрече с вирусом запоминаются организмом в виде информации, заложенной в клетки памяти (иммунологическая память), и при повторной встрече с вирусом той же антигенной разновидности иммунные реакции протекают быстрее и более эффективно. Создание иммунной памяти об антигене является целью применения вакцин. С их помощью создается и поддерживается защитная концентрация противогриппозных антител. Антитела, вступая во взаимосвязь с антигеном, образуют иммунные комплексы. Иногда вместе с защитными функциями они могут стать причиной тяжелых иммунопатологических состояний. Циркулируя по всему организму, они оседают в тканях, вызывая воспалительные реакции в капиллярах клубочков почек и синовиальных оболочек суставов. Частично вирус из организма выделяется почками, что, возможно, и обусловливает тот факт, что в эпителии дистальных канальцев, как и в эндотелии капилляров клубочков, оказывается значительное количество антигена вируса. Почками также выделяются иммунные комплексы, фрагменты клеток, что приводит к сенсибилизации тканей почки и впоследствии, через несколько недель и даже месяцев после перенесенного заболевания, может послужить причиной возникновения гломерулонефрита. Инициатором в этом случае может быть фактор, который имеет антигенную природу (например, переохлаждение).
Находясь в окружении антител, вирус может сохранять свою структуру и при разрушении комплекса опять поражать чувствительные клетки. Длительная циркуляция комплексов приводит к инфицированию все большего количества клеток, к поддержке инфекции и к персистенции. В данное время не исключается возможность длительной персистенции вируса гриппа в ЦНС по типу медленной инфекции с развитием впоследствии такого патологического состояния, как паркинсонизм. Это изменяет представление о гриппе как об острой инфекции. Установлено, что в 50% случаев антиген вируса гриппа сохраняется в периферических лимфоидных клетках и в крови до 120-200 и более дней.
При гриппе роль антигена могут играть не только структура вируса, но и измененные вирусом структуры клеток, и уже к ним синтезируются антитела, с которыми начинают вступать во взаимодействие нормальные клетки, в результате чего возникает угроза развития аутоиммунопатологического состояния.
Изменения во внутренних органах однотипны, обусловлены генерализованной вазодилятациеи. При массивной вирусемии, которая быстро развивается в первые часы болезни, может возникнуть инфекционно-токсический шок с развитием сердечно-сосудистой недостаточности. В его основе лежат несколько факторов: сосудистый (непосредственное действие вируса на сосуды с повышением их проницаемости, вазодилятациеи), геморрагический синдром с повреждением надпочечников и дефицитом гормонов, нарушение функции миокарда. У таких больных смерть может наступить в ближайшие часы от начала заболевания.
В результате токсического повреждения сосудистого аппарата ЦНС наступает гиперсекреция спинномозговой жидкости, нарушается ликвородинамика, что приводит к повышению внутричерепного давления, может наступить отек мозга. Чаще все-таки повреждаются мягкие мозговые оболочки, сосудистое сплетение, где можно выявить антигены вируса гриппа.
Инфекционно-алергический процесс после перенесенной гриппозной инфекции может возникнуть также в эндокарде. Изменения в миокарде, определенные на ЭКГ как миокардиодистрофия, обусловлены токсикозом и циркуляторными расстройствами.
В патогенезе отека легких имеют значение много факторов: нарушения гемодинамики, связанные с токсикозом, воспалительные процессы в бронхах и легких, снижение сократительной функции левого желудочка, что чаще развивается у лиц с сопутствующими заболеваниями сердечно-сосудистой системы. Необходимо подчеркнуть, что начальные стадии отека легких, на которых повреждается интерстициальная ткань, определяются лишь рентгенологически в виде нерезких, расплывчатых теней, которые сливаются и распространяются от корней к периферии легочных полей.
В механизмах устойчивости организма к генетически инородной информации принимают участие два основных феномена: наследственная резистентность и приобретенный иммунитет:
- природная видовая наследственная резистентность, связанная с врожденной стойкостью организма, которая развивается с возрастом, к возбудителям инфекций, основанная на отсутствии чувствительных клеток или повышении их резистентности к репродукции вируса, а также на их биологической инактивации при участии интерферона, фагоцитарных факторов, нормальной температуры тела или неспецифических ингибиторов крови;
- приобретенный иммунитет создается после болезни или искусственной иммунизации вакцинами.
Приобретенный иммунитет опирается на формирование местной секреторной защиты. Секреторный иммунитет предупреждает или смягчает тяжесть заболевания во входных воротах гриппозной инфекции при участии антител класса IgA, которые синтезированы в процессе кооперации между В-лимфоцитами и эпителиальными клетками. Секреторные антитела избирательно адсорбируются на поверхности клеток мерцательного эпителия, эффективно защищая их от инвазии вируса.
Длительность противогриппозного иммунитета ограничена не дву-мя-тремя годами, как это считалось бесспорным до 1977 г. (в этот год особенно тяжело болели молодые люди, рожденные после 1957 г., когда вирус A (h2N1) исчез из циркуляции и появился снова в 1977 г.). В случае возвращения к активной циркуляции уже известного подтипа через 20 и более лет — выявляется сохранение специфической невосприимчивости к возбудителю, который вернулся, у части населения, которая контактировала с ним раньше. Такая длительная иммунологическая память обусловлена, конечно, не антителами (их титры в крови падают ниже защитного порога через 6-12 месяцев, а в секрете дыхательных путей — еще быстрее). Длительный постинфекционный иммунитет обеспечивают клеточные механизмы (Т- и В-лимфоциты), в том числе местные, во входных воротах возбудителя инфекции. Существует четко выраженная корреляция невосприимчивости к гриппу с концентрацией антител в крови (в основном IgG) и в секрете дыхательных путей (IgA). Однако в частных случаях гриппом могут заболеть люди с высоким исходным уровнем гуморального иммунитета и не заболевают инфицированные лица с низким начальным титром антител. Такие примеры подчеркивают сложность и многогранность иммунной защиты организма, где роль отдельных факторов интегрирована в общем результате.
Между специфическими механизмами противогриппозного иммунитета существует распределение защитных функций:
- секреторные антитела, которые подавляют репродукцию вируса во входных воротах инфекции, обеспечивают противоэпидемическую защиту, направленную на ограничение рассеивания и передачи возбудителя от инфицированных лиц здоровому окружению; в связи с широким диапазоном нейтрализующего эффекта секреторные антитела способны подавлять любые антигенные варианты вируса гриппа А в пределах своего подтипа;
- сывороточные антитела нейтрализуют токсичные продукты вируса и регулируют клиническую тяжесть болезни;
- клеточно-обусловленные факторы иммунитета устраняют резервуар вируса в инфицированных клетках, малодоступных влиянию антител.
Напряженность противовирусного иммунитета зависит от уровня циркулирующих антител и образования цитотоксических лимфоцитов. Цитотоксические лимфоциты вызывают лизис инфицированных вирусом клеток.
Повторное заболевание гриппом обусловлено высокой изменчивостью вируса гриппа и формированием иммунитета только к конкретному штамму, что и объясняет необходимость ежегодной вакцинации.
«ГРИПП
Пособие для врачей, Санкт-Петербург — Харьков, 2007»
Далее »» Клиническая картина
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Научный журнал
Научное обозрение. Медицинские науки
ISSN 2500-0780
ПИ №ФС77-57452
- Авторы
- Файлы
- Литература
- English
Чеснокова Н.П. 1 Понукалина Е.В. 1 Полутова Н.В. 1 Брилль Г.Е. 1 Кудин Г.Б. 1
1 Саратовский государственный медицинский университет им. В.И. Разумовского
1. Гриппи М.А. Патофизиология легких. — М.: БИНОМ, 2015. — 304 с.
2. Дедов И.И. Эндокринология: учебник / И.И. Дедов, Г.А. Мельниченко. — М.: ГЭОТАР-Медиа, 2013. — 752 с.
3. Зайчик А.Ш. Патофизиология: в 3 томах. Том 1. Общая патофизиология (с основами иммунологии): учеб. / А.Ш. Зайчик, Л.П. Чурилов. — 4-е изд. — СПб.: ЭЛБИ-СПб, 2008. — 656 с.
4. Зайчик А.Ш. Патологическая физиология. Том 2. Патохимия: учеб. / А.Ш. Зайчик, Л.П. Чурилов. — 3-е изд. — СПб.: ЭЛБИ-СПб, 2007. — 688 с.
5. Кэттайл В.М. Патофизиология эндокринной системы: учеб. / В.М. Кэттайл, Р.А. Арки. — СПб. — М.: «Невский Диалект» — «Изд-во БИНОМ», 2001. — 336 с.
6. Литвицкий П.Ф. Патофизиология: учеб. — 5-е изд. — М.: ГЭОТАР-Медиа, 2015. — 496 с.
7. Патологическая физиология: учеб. / под общ. ред. В.В. Моррисона, Н.П. Чесноковой. — 4-е изд. — Саратов: Изд-во Сарат. гос. мед. ун-та, 2009. — 679 с.
8. Серов В.Н. Гинекологическая эндокринология / В.Н. Серов, В.Н. Прилепская, Т.В. Овсянникова. — 5-е изд. — М.: МЕДпресс-информ, 2015. — 512 с.
9. Физиология человека / под ред. акад. РАМН Б.И. Ткаченко. — М.: ГЭОТАР-Медиа, 2009. — 496 с.
10. Нормальная физиология / под ред. В.М. Смирнова. — 3-е изд., перераб. и доп. — М.: «Академия», 2010. — 480 с.
11. Физиология человека / под ред. В.Ф. Киричука. — Саратов, 2009. — 343 с.
1 1 1 1 1
1
Abstract:
Keywords:
Отек легких. Отек легких — патологическое состояние полиэтиологической природы, характеризующееся усиленной транссудацией жидкости из сосудов микроциркуляторного русла легких в интерстициальную ткань или альвеолы.
В 23% наблюдений отек легких возникает при сердечно-сосудистой недостаточности, а также при эмболии сосудов малого круга кровообращения. Отек легких может быть осложнением тяжелых инфекций и интоксикаций (корь, скарлатина, брюшной тиф, чума), обструкции воздухоносных путей, почечной и печеночной недостаточности.
В этиологии отека легких немалое место занимает ингаляционное воздействие промышленных ядов, раздражающих газов: хлора, метана, фосгена, фреона, паров аммиака, синильной, уксусной, масляной и минеральных кислот.
Отек легких нередко возникает при передозировке ряда лекарственных соединений: наркотиков, снотворных, препаратов, угнетающих сократительную функцию миокарда, холинолитиков, стимуляторов α-адренорецепторов.
Причиной развития отека легких могут быть блокаторы β-адренергических рецепторов, антихолинэстеразные средства.
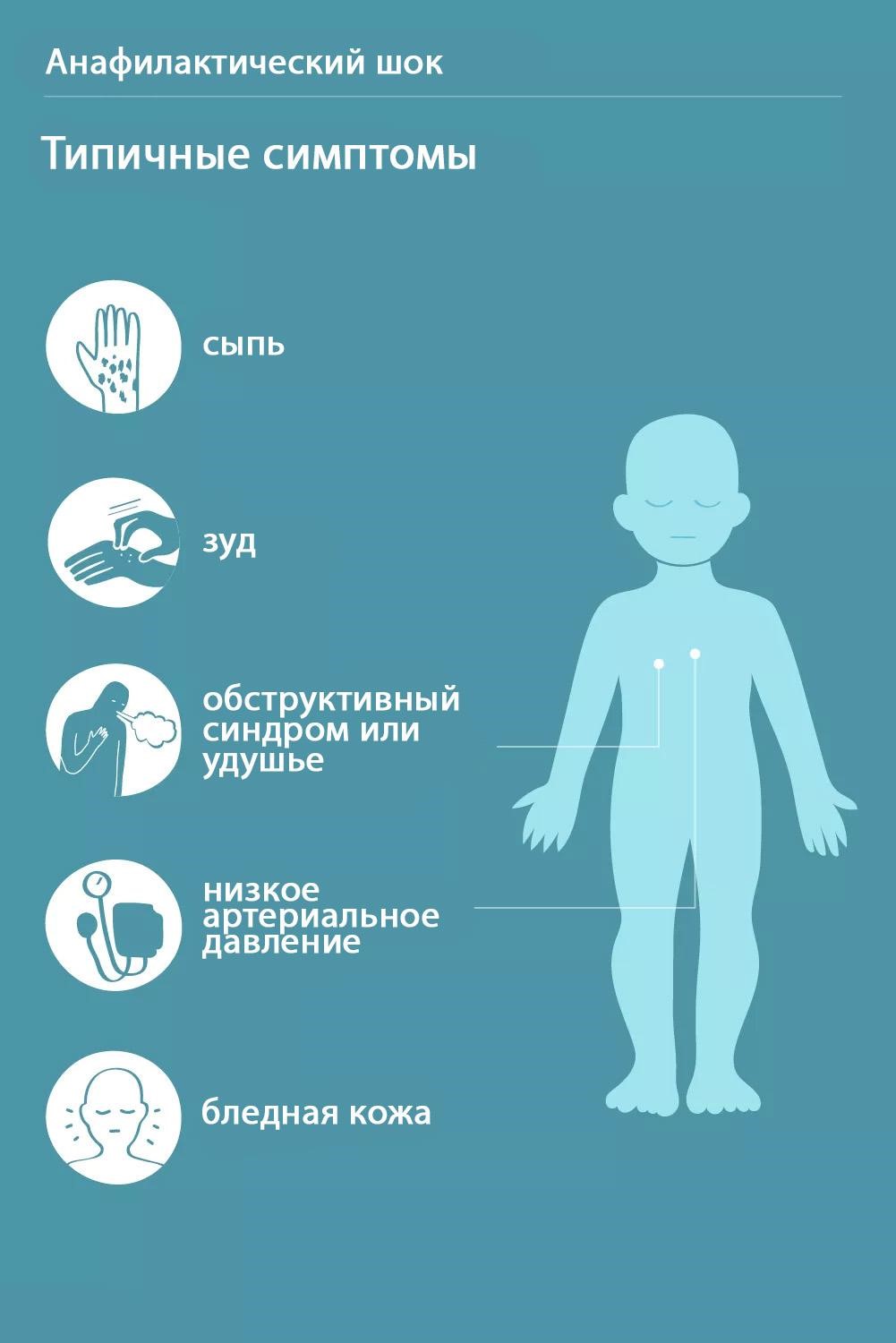
Отек легких может возникать при анафилактическом шоке, быстром выведении асцитической жидкости.
Инициировать развитие отека легких могут препараты, задерживающие воду в организме (кортикостероиды, салицилаты, адреналин, производные пирозалона).
Действие вышеуказанных этиологических факторов приводит к инициации следующих разновидностей отека легких: мембранозного, гемодинамического, онкотического, лимфодинамического.
1. Мембранозный отек связан с деструкцией альвеолярно-капиллярной мембраны, повышением ее проницаемости под влиянием медиаторов воспаления и аллергии (гистамина, лейкотриенов, кининов, лизосомальных гидролаз, простагландинов, активных форм кислорода).
Повышение проницаемости альвеолярно-капиллярной мембраны возникает при тяжелых формах системной гипоксии, местных расстройствах кровообращения в легких в случаях тромбоза, эмболии, кровоизлияний, когда снижается продукция сурфактанта, а также при ирритантном воздействии токсических раздражающих веществ.
Через поврежденный эндотелий и базальную мембрану легочных сосудов перемещаются вода, электролиты, белки плазмы, форменные элементы крови в интерстиций легочной ткани.
2. Гемодинамический отек возникает при повышении гидродинамического давления в легочных капиллярах.
Прежде всего, необходимо остановиться на гемодинамических особенностях в системе малого круга кровообращения по сравнению с таковыми в большом кругу кровообращения.
Так, гидродинамическое давление в артериальном колене капилляров различных внутренних органов и тканях большого круга кровообращения в норме составляет 40 гПа (32 мм рт. ст.), а в легочных капиллярах — 3-14 гПА (2-11 мм рт. ст.). Таким образом, даже незначительное возрастание гидродинамического давления в сосудах легких приводит к усилению транссудации и является риском развития отека легких. Как известно, возрастание гидродинамического давления в легких может быть связано с увеличением притока крови, затруднением оттока или возрастанием внутрисосудистого сопротивления в легких.
В связи с этим легочная гипертензия может иметь гиперкинентическое (гипердинамическое), застойное или вазогенное происхождение.
В большинстве случаев в возрастании гидростатического давления играют роль все три механизма, включающиеся последовательно или одновременно.
Отек легких гипердинамического генеза развивается нередко в результате избыточной гемотрансфузии или внутривенного введения безбелковых соединений.
Перегрузка жидкостью обусловливает не только возрастание гидродинамического давления в легочных капиллярах, но и снижение коллоидно-осмотического давления в крови. Отек легких формируется при незначительном возрастании гидродинамического давления на 13-16 гПА (10-12 мм рт. ст.).
3. Онкотический отек связан с развитием гипопротеинемии. Как известно, основной силой, удерживающей жидкость в легочных капиллярах, является коллоидно-осмотическое давление крови. При уменьшении концентрации белков в крови на 47-50% развивается отек.
Следует отметить, что около 80% воды задерживается в сосудистом русле альбуминами, и уменьшение их содержания даже при стабильно-нормальном уровне общего белка является фактором риска развития отека легких.
4. Лимфодинамический отек наблюдается при блокаде лимфатического дренажа. У здорового человека отток лимфы составляет 15-20 мл/ч, по мере необходимости он может увеличиваться в 15 раз. При врожденном дефекте развития лимфатических сосудов, формировании лимфоэктазий, воспалении лимфатических сосудов или их компрессии затрудняется лимфоотток, и жидкость накапливается в легочной ткани.
Стадии развития отека легких и характер нарушения внешнего дыхания. Прогрессирующее течение отека легких характеризуется последовательным развитием трех стадий: интрамурального, интерстициального и альвеолярного отека.
1. Интрамуральная стадия характеризуется усилением гидратации альвеолярно-капиллярной мембраны и ее утолщением, что естественно приводит к ослаблению альвеолярного дыхания за счет снижения эффективного диффузного давления для кислорода и углекислоты.
2. Интерстициальная стадия связана с отеком соединительнотканных структур, а также периваскулярных, перибронхиальных пространств, межальвеолярных перегородок. Для этой стадии характерно накопление в легочной ткани биологически активных веществ клеточного и гуморального происхождения (гистамина, серотонина, гепарина, лейкотриенов, интерлейкинов), вызывающих массивное повреждение эндотелия микроциркуляторного русла и увеличение проницаемости сосудистой стенки. Через поврежденную стенку плазма выходит в интерстиций легочной ткани. На первых этапах жидкость не попадает в альвеолы вследствие работы компенсаторных механизмов: повышение интерстициального гидростатического давления увеличивает скорость тока жидкости от малорастяжимого перимикроваскулярного к более растяжимому бронховаскулярному интерстицию, в котором находятся терминальные лимфатические сосуды, впадающие в конечном итоге в центральную вену. По мере накопления отечной жидкости вокруг терминальных лимфатических сосудов ток легочной лимфы может возрастать в 15 раз, поддерживая тем самым баланс жидкости в легких.
Отек легких возникает только тогда, когда резервные дренажные возможности лимфатических сосудов первоначально недостаточны или исчерпываются. Накопление жидкости в интерстиции ведет к набуханию волокон коллагена и эластина и снижению растяжимости легочной ткани. Происходит компрессия бронхиол, кровеносных и лимфатических сосудов «водными манжетами». После достижения критического уровня жидкость устремляется в альвеолы.
Касаясь нарушений внешнего дыхания в эту стадию, следует отметить наличие в паренхиме легких высокопороговых быстроадаптирующихся юкстакапиллярных рецепторов n. vagus, реагирующих в условиях патологии на возрастание объема интерстициальной жидкости. Возникающая с этих рецепторов афферентация при интерстициальном отеке поступает по мало- и немиелинизированным чувствительным волокнам n. vagus в бульбарный инспираторный отдел дыхательного центра, что приводит к повышению их возбудимости и развитию тахипноэ.
5. Альвеолярный отек возникает, когда истощаются дренажные способности лимфатической системы, хотя они и превышают необходимый объем оттока лимфы примерно в 15 раз.
При интерстициальном отеке возникает компрессия кровеносных и лимфатических сосудов, бронхиол, что приводит к дальнейшему возрастанию гидростатического давления и усилению ультрафильтрации плазмы через альвеолярно-капиллярную мембрану в альвеолы.
Транссудат из интерстиция фильтруется в альвеолы, проходя между эпителиальными клетками, вымывает сурфактант, альвеолы спадаются, проницаемость альвеолярно-капиллярной мембраны еще более возрастает. Кроме того, транссудат поступает в альвеолы и воздухоносные пути, что усугубляет гипоксемию. Альвеолы заполняются транссудатом, богатым фибриногеном. Образующаяся фибриновая выстилка создает условия для формирования гиалиновых мембран. Под влиянием транссудата сурфактант смывается с поверхности альвеол и вызывает вспенивание транссудата в процессе вдыхания воздуха. Последнее приводит к эмболии воздухоносных путей, дальнейшему подавлению синтеза сурфактанта, развитию ателэктазов. Снижается объем оксигенированной крови из-за перфузии невентилируемых альвеол. Кровь, проходя через эти альвеолы, остается венозной и смешивается с кровью, прошедшей мимо альвеол с нормальной оксигенацией; развивается циркуляторная гипоксия.
Принципы патогенетической терапии отека легких включают использование:
1) симпатолитиков, траквилизаторов, анальгетиков;
2) спазмолитиков, сосудорасширяющих препаратов;
3) диуретиков и дегидрационных средств;
4) разгрузки малого круга кровообращения (сидячее положение, горячие ножные ванны, наложение жгута на конечности);
5) пеногасителей.
Библиографическая ссылка
Чеснокова Н.П., Понукалина Е.В., Полутова Н.В., Брилль Г.Е., Кудин Г.Б. ОТЕК ЛЕГКИХ. ЭТИОЛОГИЧЕСКИЕ ФАКТОРЫ, ПАТОГЕНЕЗ // Научное обозрение. Медицинские науки. — 2016. — № 1. — С. 79-81;
URL: https://science-medicine.ru/ru/article/view?id=878 (дата обращения: 27.06.2021).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
- Мустафин Р. И., Протасова А. А., Буховец А. В., Семина И.И. Исследование интерполимерных сочетаний на основе (мет)акрилатов в качестве перспективных носителей в поликомплексных системах для гастроретентивной доставки. Фармация. 2014; 5: 3–5.
- Мустафин Р. И., Протасова А. А., Буховец А. В., Семина И.И. Исследование интерполимерных сочетаний на основе (мет)акрилатов в качестве перспективных носителей в поликомплексных системах для гастроретентивной доставки. Фармация. 2014; 5: 3–5.
- Baas, «Geschichte d. Medicin».
- https://medi.ru/info/12035/.
- https://science-medicine.ru/ru/article/view?id=878.
- Ковнер, «Очерки истории M.».
- М.П. Киселева, З.С. Шпрах, Л.М. Борисова и др. Доклиническое изучение противоопухолевой активности производного N-гликозида индолокарбазола ЛХС-1208. Сообщение I // Российский биотерапевтический журнал. 2015. № 2. С. 71-77.
- М.П. Киселева, З.С. Смирнова, Л.М. Борисова и др. Поиск новых противоопухолевых соединений среди производных N-гликозидов индоло[2,3-а] карбазолов // Российский онкологический журнал. 2015. № 1. С. 33-37.
- Мустафин Р. И., Буховец А. В., Протасова А. А., Шайхрамова Р. Н., Ситенков А. Ю., Семина И. И. Сравнительное исследование поликомплексных систем для гастроретентивной доставки метформина. Разработка и регистрация лекарственных средств. 2015; 1(10): 48–50.