Пандемия коронавируса заставила миллионы людей задуматься о том, что наука на самом деле знает про мир вирусов. Может ли она защитить людей? Предсказать следующую атаку вирусов?
Об этом «РГ» беседует с молекулярным вирусологом, и.о. директора Института биомедицинских систем и биотехнологий Санкт-Петербургского политехнического университета Петра Великого, доктором биологических наук Андреем Васиным.
Андрей Владимирович, пандемия COVID-19 открыла нам глаза на то, что мир вирусов способен преподнести людям немало сюрпризов, хотя мы сталкиваемся с ними постоянно. Почему, на ваш взгляд, новый вирус оказался таким шоком для человечества?
Андрей Васин: Подавляющее большинство людей просто недооценивало опасность, которую представляют вирусы. Почти все слышали такие слова, как «Эбола», «птичий грипп», «вирус Зика», «атипичная пневмония». Но все это было в заголовках новостей и где-то далеко — в Африке, Юго-Восточной Азии, Южной Америке — и не касалось непосредственно нас. Не случайно, наверное, что страны Юго-Восточной Азии, которые сталкивались с некоторыми из перечисленных вирусов, оказались более подготовленными к реагированию на COVID-19, чем, например, страны Европы.
Охвативший весь мир «свиной грипп» (т.е. вирус гриппа A/h2N1), объявленный пандемией, воспринимался просто как осложненный грипп. Плюс к этому было много разговоров про то, что это все обман с целью отвлечения внимания людей от каких-то более важных проблем, «заговор фармкомпаний, чтобы продавать больше препаратов», и т.п. А сейчас оказалось, что угроза пандемии реальна и может затронуть всех. К такому повороту событий общество многих стран, мне кажется, не было готово.
Известно, что вирусы крайне изменчивы. Чем объясняется эта их способность?
Андрей Васин: В основе всей жизни на земле лежит процесс репликации, то есть копирования генома, который у всех клеточных форм жизни представлен молекулой ДНК. За этот процесс в клетках отвечают специальные ферменты, которые называются полимеразы. В процессе репликации ДНК (у человека размер генома, например, составляет 10 в девятой степени!) неизбежно возникают ошибки. Поэтому в процессе эволюции появились специальные ферменты, которые отвечают за репарацию, то есть за устранение этих ошибок. У вирусов геном может быть представлен молекулой как ДНК, так и РНК. При этом РНК-содержащие вирусы являются более изменчивыми и патогенными, чем ДНК-содержащие. В частности, к РНК-содержащим вирусам человека относятся ВИЧ, вирус Эбола, вирус Зика, вирусы гриппа и коронавирусы, в том числе COVID-19. Изменчивость РНК-содержащих вирусов связана с тем, что у них, как правило, нет систем репарации. В результате вирусная полимераза совершает ошибки довольно часто. Размер генома вируса гораздо меньше, поэтому у них на каждый цикл репликации приходится в среднем одна мутация. С учетом скорости размножения вируса и скорости его распространения в популяции число мутаций будет довольно велико, что и объясняет такую изменчивость.
Подавляющее большинство людей недооценивали опасность, которую представляют вирусы
А помимо постепенного накопления мутаций в геноме РНК-содержащих вирусов возможны и более резкие изменения, например, в процессе реассортации и рекомбинации. Реассортация — это перемешивание сегментов генома разных вирусов. Если эти сегменты были от вирусов разных хозяев (например, человека и птицы), такой новый вирус чаще всего бывает нежизнеспособным. Однако в редких случаях он все же получает возможность эффективно размножаться и передаваться от человека к человеку. Именно таким образом возникали все известные пандемии гриппа. Для некоторых вирусов с монолитным геномом возможна рекомбинация, то есть обмен фрагментами генома между разными штаммами.
В частности, такие механизмы встречаются у коронавирусов. Реассортация и рекомбинация приводят не к плавным, а к резким изменениям биологических свойств вируса. Такая изменчивость и является одним из ключевых факторов их способности ускользнуть от иммунитета человека.

Способность коронавирусов быстро меняться помогает им обойти иммунитет человека. Фото: Сергей Карпухин / ТАСС
В состоянии ли наука предсказать появление более опасных штаммов тех вирусов, которые давно циркулируют среди людей?
Андрей Васин: Наука в состоянии предположить, что может сделать уже известные вирусы более опасными, изучая их молекулярно-генетические механизмы. Мы можем предполагать, на какие вирусы стоит обратить особое внимание с точки зрения их пандемического потенциала. Но сказать, какое именно событие усилит патогенность вируса в реальности и тем более когда оно произойдет, к сожалению, пока невозможно.
Известно, что существует около 250 вирусов, вызывающих ОРВИ. Однако для них не создано ни тест-систем, ни вакцин. С чем это связано? И оправдано ли такое спокойствие человечества?
Андрей Васин: Сложно дать однозначный ответ. С одной стороны, обычные люди и даже многие медики считают, что вызванные вирусами респираторные заболевания в целом схожи друг с другом, и подход к их лечению примерно одинаковый. Единственное исключение составляет грипп, при этом многие люди гриппом называют все ОРВИ. Зачем тогда тратить время и деньги на их дифференциальную диагностику? Считается, что важно определить, вирус или бактерия вызвали заболевание, а если вирус, то грипп это или нет, а остальное неважно. Ведь специфических противовирусных препаратов для других респираторных вирусов нет — в отличие от множества антибиотиков против бактериальных инфекций. Но каждый вирус имеет свою собственную программу репликации в организме, поэтому и течение инфекции тоже будет отличаться, а значит, и схема лечения тоже должна иметь отличия. Как молекулярный вирусолог, я считаю, что ставить диагноз ОРВИ и не обращать внимания на то, какой вирус ее вызвал, неправильно. Возможно, медицинские вирусологи и инфекционисты не будут столь категоричны. Но я уверен, что по мере изучения респираторных вирусов нас ждет еще много сюрпризов, в том числе в механизмах их патогенеза и развития осложнений.
Инвестиции в вирусологию можно сравнить со страховым полисом на автомобиль
Но тест-системы на определение ОРВИ есть, они широко используются в системе надзора за гриппом и другими ОРВИ, осуществляемой, в частности, Национальным центром ВОЗ на базе НИИ гриппа им. Смородинцева Минздрава России. Что касается вакцин, то ОРВИ преимущественно вызваны РНК-содержащими, то есть сильно изменчивыми вирусами, и создать эффективную вакцину от них не так просто. Мы это видим на примере вакцины от гриппа, состав которой меняется ежегодно, и прививаемся мы ею не единожды в жизни, а практически каждый год. Попытки создать вакцины и против других ОРВИ предпринимались в 1960-е годы, но они оказались безуспешными. Ярким примером является респираторно-синцитиальная инфекция, вызывающая тяжелые заболевания нижних дыхательных путей, особенно у младенцев и детей младшего возраста. Была получена инактивированная вакцина, но на стадии клинических испытаний она не только не позволила защитить от инфекции, но и существенно утяжелила заболевание. После этого работы по вакцине против РС-инфекции были надолго закрыты. Только в наше время вновь вернулись к активной разработке этих вакцин, когда открыли молекулярные механизмы усиления инфекции, возникавшего при использовании вакцины в те годы, но уже с использованием новых технологий. Сейчас на стадии доклинических и клинических исследований находится несколько десятков вакцинных препаратов. Мы также проводим доклинические исследования нашего варианта вакцины против РС-инфекции в НИИ гриппа, работа финансируется Центром стратегического планирования и управления медико-биологическими рисками здоровью Минздрава России.
А были ли попытки создать вакцины от коронавирусов?
Андрей Васин: Среди сезонных респираторных вирусов встречается 4 типа коронавирусов: OC43, HKU1, NL63 и 229E. И если про коронавирусы SARS (атипичной пневмонии) и MERS (ближневосточного респираторного синдрома) люди еще слышали, то про эти четыре коронавируса ничего не знают. Против них не было разработано ни лекарств, ни вакцин. Если бы они были, мы чувствовали бы себя сейчас намного уверенней и смогли бы гораздо быстрее создать вакцину или лекарственный препарат от COVID-19.
На нашей памяти — эпидемия Эбола в Африке, вспышки других опасных вирусных лихорадок. Какие уроки были извлечены из них?
Андрей Васин: Вирус Эбола был хорошо известен специалистам и до эпидемии. Локальные вспышки заболевания фиксировались, но при чрезвычайно высокой летальности число заболевших было невелико. Эпидемия столь опасного вируса особенно в условиях бедных стран Африки — это событие чрезвычайное, требующее неотложных мер, что в конечном итоге и было сделано. На момент начала эпидемии различными лабораториями разрабатывался целый ряд препаратов против вируса Эбола, в том числе с использованием новых технологий. Был определенный задел и по вакцинам, который позволил оперативно инициировать их разработку. Эпидемия Эбола позволила апробировать целый ряд новых биотехнологических решений, которые можно применять в дальнейшем для борьбы и с другими вирусными инфекциями.
Как вы полагаете, какие изменения в нашей жизни, в организации санэпиднадзора и системы здравоохранения должны будут произойти после нынешней пандемии?
Андрей Васин: Основные изменения будут связаны скорее всего с экономическими последствиями пандемии. ВОЗ постоянно говорит о необходимости подготовки к пандемиям, разработаны соответствующие «дорожные карты». После пандемии COVID-19 эта работа будет усилена как на глобальном уровне, так и на уровне отдельных стран. А в обычной жизни, надеюсь, люди будут уделять гораздо больше внимания правилам личной гигиены, более ответственно относиться к респираторным заболеваниям и не приходить, например, на работу или в места скопления людей с ОРВИ, заражая окружающих. По крайней мере, хотя бы в первое время.
Многие годы нам рекомендовали в качестве профилактики вирусных инфекций то витамины, то модуляторы интерферонов. Теперь об этом что-то молчат. Установки изменились?
Андрей Васин: Возможно, появилась ответственность за то, что предлагаешь, так как спрос на эти предложения будет действительно серьезный. Надеюсь, что одним из положительных последствий ситуации будет и более серьезное отношение к тому, чем предлагается лечить ОРВИ. А также то, что число сторонников антипрививочного движения сократится. Ведь вакцины — это одно из величайших достижений человечества, позволившее спасти миллиарды человеческих жизней.
Как вы считаете, нужно ли все же выделить средства на изучение вроде бы не очень опасных респираторных вирусов, разработку тест-систем, доступную диагностику, вакцинопрофилактику и терапию?
Андрей Васин: Несомненно! В «мирное» время кажется, что есть более важные задачи, но вирусы — это реальная угроза человечеству. Мы живем в условиях постоянной биологической войны, только не рукотворной, а природной, которая длится миллиарды лет. Мы никогда не сможем полностью исключить вирусную угрозу, но должны быть максимально готовы ее предотвратить. Биологическая наука развивается семимильными шагами. Например, всего за несколько дней после идентификации вируса COVID-19 его геном был секвенирован и депонирован в общедоступные базы данных, что позволило оперативно начать разработку тест-систем и вакцин. В 2009 году, во время пандемии гриппа, вызванного вирусом А/h2N1, этот процесс занял гораздо больше времени. Нам нужно более подробно изучать вирусы человека и животных. Не надо забывать, что основной путь появления новых инфекций — зоонозный, поэтому крайне важно знать, что происходит с вирусами в естественных животных резервуарах. Нужно развивать новые технологии создания вакцин и препаратов. В этом смысле многообещающе выглядят РНК-вакцины, неслучайно им сейчас уделяют столько внимания. Именно это направление мы выбрали в СПбГПУ как основное.
Не знаю, насколько уместно будет такое сравнение, но инвестиции в вирусологию — это как страховой полис на автомобиль. Пока с автомобилем все в порядке, кажется: зачем я заплатил за полис, лучше бы потратил на что-то более насущное. Но если с автомобилем что-то случилось, начинаешь понимать, что без страхового полиса ты остался бы ни с чем. Думаю, что даже небольшой части суммы экономических потерь от нынешней пандемии хватило бы на поддержание и оснащение вирусологических лабораторий по всему миру на многие годы.

Инфографика «РГ» / Александр Чистов / Татьяна Батенёва
Молекулярное двурушничество: гены человека работают на вирус гриппа
Геном вируса гриппа A (в том числе, свиного происхождения) кодирует не более 11 белков, вследствие чего вирус активно использует клеточные механизмы заражённого организма в своих целях. В результате полногеномного сканирования с помощью РНК-интерференции установлен список из почти 300 человеческих генов, которые нужны вирусу для ранних стадий жизненного цикла. Среди белков-«предателей» — вакуолярная АТФаза, коатомеры комплекса Гольджи, рецептор фактора роста фибробластов, кальмодулин-зависимая протеинкиназа и многие другие. Эта информация будет использована для создания новых поколений антивирусных препаратов — ингибиторов определённых человеческих белков.
Вирусы гриппа (рис. 1) ежегодно вызывают волны заболеваемости, а в отдельных случаях становятся причиной пандемий с высоким уровнем смертности. Среди таких происшествий можно назвать пандемии 1918-го, 1957-го и 1968-го годов, а также находящуюся на слуху вспышку свиного гриппа 2009 года. Геном вируса гриппа кодирует не более чем одиннадцать (!) белков, из которых только два являются мишенями современных противовирусных средств, утверждённых американским управлением FDA, — нейраминидаза и ионный канал M2. Основные из этих лекарств — озельтамивир (тамифлю), занамивир (реленза), амантадин и римантадин, причём к каждому из них современные штаммы вируса уже успели выработать устойчивость.
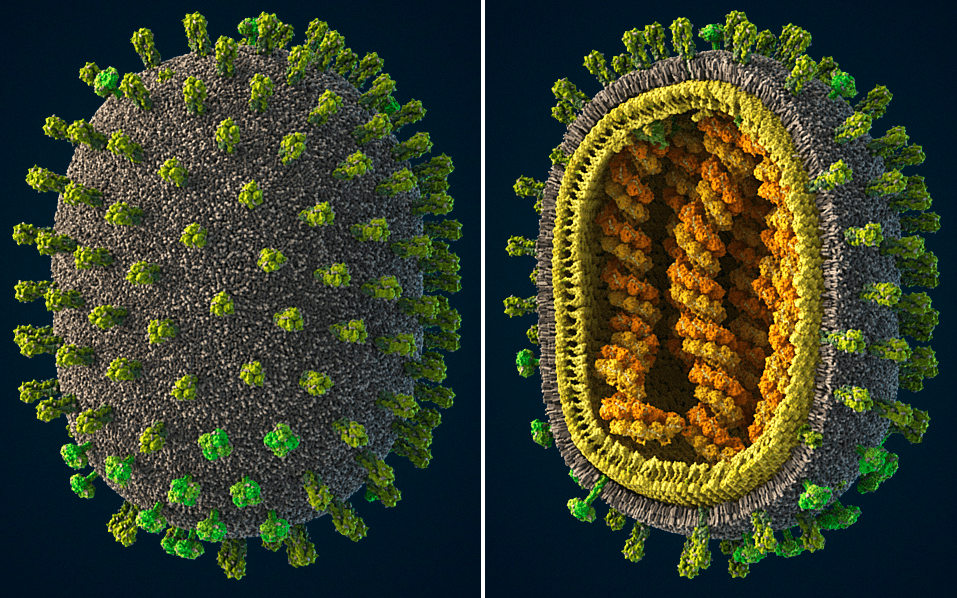
Рисунок 1. Вирусы гриппа относятся к семейству Orthomyxoviridae. Они патогенны для человека, некоторых млекопитающих и многих птиц. У человека и млекопитающих вирус поражает верхние дыхательные пути, а у птиц инфекция затрагивает преимущественно кишечник. Эти вирусы характеризуются высокой изменчивостью и широким кругом хозяев. Заболевание гриппом периодически распространяется в виде эпидемий и пандемий. Тяжесть и характер течения заболевания варьирует в зависимости от штамма вируса. Другие иллюстрации капсида вируса, 3D-модель, интерактивную схему и более полное описание смотри на сайте visualscience.ru.
Учитывая принципиально малое число возможных вирусных белков-мишеней, феноменальную изменчивость вирусов (а, следовательно, способность вырабатывать устойчивость) и их глубокое внедрение во множество клеточных процессов во время инфекции, всё большую привлекательность получает идея противовирусных средств, направленных не напрямую на белки вируса, а на клеточные механизмы «хозяина», участвующие в жизненном цикле агрессора. Однако этот путь требует досконального изучения молекулярных механизмов размножения вируса внутри клетки носителя, а также составления полного перечня «хозяйских» белков, которые участвуют в процессе инфекции и репликации вируса.
Некоторые такие белки известны уже давно: например, сиалогликорецепторы клеточной мембраны, узнаваемые вирусным гемагглютинином перед «взломом» клетки. (Кстати, именно изменчивость и разнообразие форм гемагглютинина различных штаммов вируса определяет круг потенциальных «хозяев» (человек, другие млекопитающие, птицы) и возможность перескакивать с одного носителя на другого — см., например, «Объяснена различная вирулентность вирусов гриппа — возбудителей «испанки»» [1].)
Но это — отдельный, наиболее хорошо изученный путь. А сколько их всего? Ответ на этот вопрос начал вырисовываться около двух лет назад (в 2008 году), когда в систематическом полногеномном сканировании с последовательным «выключением» почти каждого гена в культуре человеческих клеток был составлен список генов-«предателей», работающих на вирус СПИДа («Подножка для вируса СПИДа» [2]). Ошеломляющий размер этого списка — более 250 генов! — почти на порядок превзошёл предположения, показав, насколько глубоко вирусы внедряются в биохимию носителя, в нашем случае — человека.
Эта работа положила начало целому ряду подобных проектов — кроме ВИЧа, аналогичным образом изучены вирусы гепатита C, тропической лихорадки денге и западно-нильского энцефалита. Теперь этот перечень пополнил и вирус гриппа A, причём масштабное сканирование на основе РНК-интерференции выполнили сразу два коллектива учёных, опубликовавших свои отчёты в одном номере Nature [3], [4].
Задачи, постановка эксперимента и, следовательно, результаты у немецких [4] и американских [3] исследователей несколько отличались, но главный принцип был тот же: на основе библиотеки из нескольких десятков тысяч коротких интерференционных РНК (киРНК) проводили изучение развития вируса гриппа в культуре эпителиальных клеток человека с «выключенным» геном — в каждом случае одним из примерно 20000. (РНК-интерференция — явление, с помощью которого можно селективно и обратимо подавлять активность генов.) В случае если вирус в таких клетках не развивался или развивался замедленно (но сами клетки при этом чувствовали себя нормально), считали, что ген связан с репликацией вируса. Кстати, учитывая огромное число исследуемых генов и, значит, необходимых экспериментов, нужно отметить, что такое сканирование проводилось в формате высокоплотных микроматриц (рис. 2б). Число идентифицированных генов — потенциальных «предателей» — в обоих случаях приближается к 300, что практически совпадает с аналогичной цифрой для ВИЧа [2].
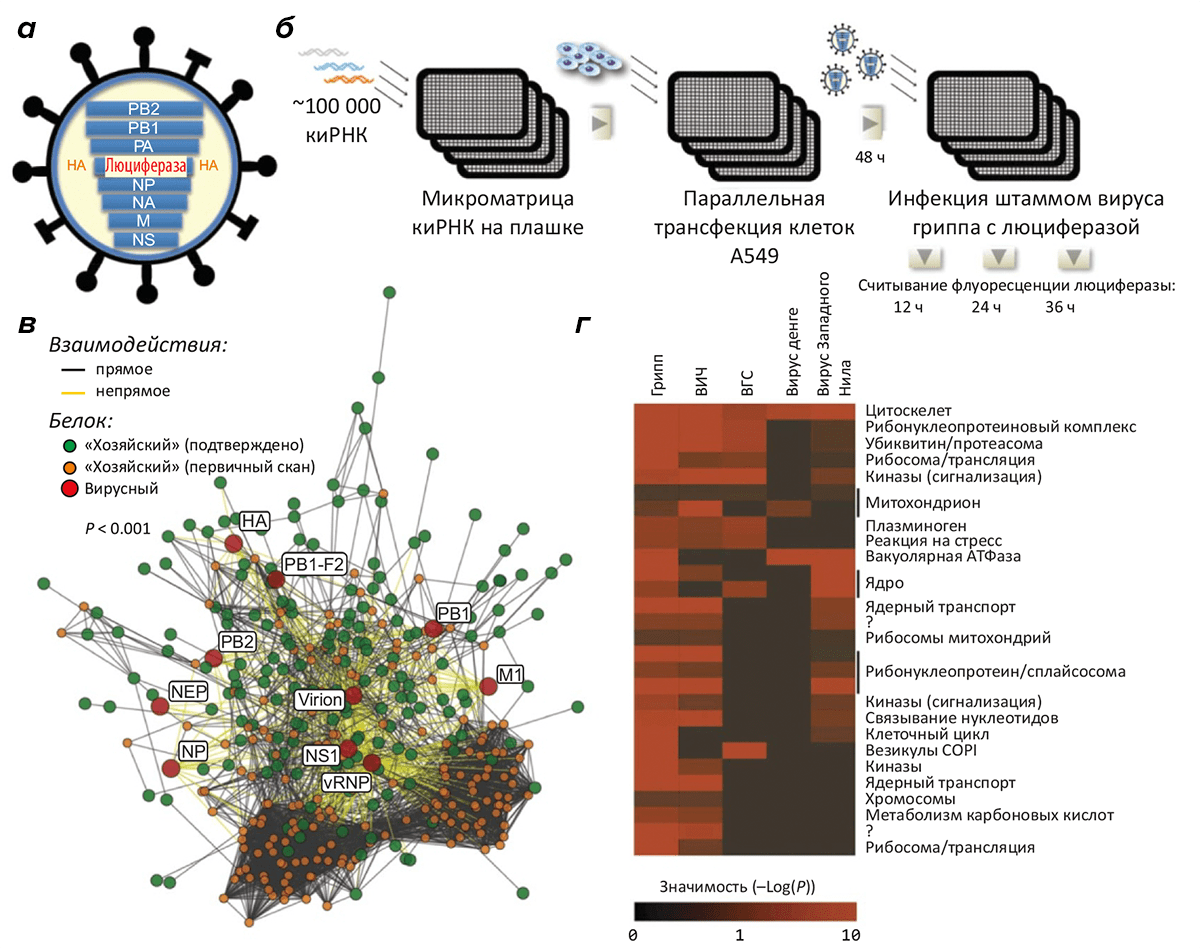
Рисунок 2. Масштабное сканирование генов, «пособничающих» размножению вируса гриппа. а — Схема рекомбинантного вируса, основанного на штамме A/WSN/33, у которого ген гемагглютинина заменён геном люциферазы для облегчения «считывания» данных об инфекции по флуоресцентному сигналу. б — Библиотека киРНК, подготовленная в формате микроматрицы лунок, используется для «выключения» в клетках лёгочного эпителия A549 одного из генов по принципу РНК-интерференции. (Исследована инактивация ~19000 генов.) Трансфицированные клетки в лунках заражали вирусом и по интенсивности флуоресценции контролировали развитие инфекционного процесса. в — Сеть взаимодействий десяти вирусных белков и клеточных факторов. г — Предсказанные взаимодействия с белкáми человека вирусов гриппа, СПИДа, гепатита C, лихорадки денге и лихорадки Западного Нила (данные для всех вирусов, кроме первого, взяты из литературы). Интенсивность красного цвета показывает значимость предсказания.
Остановимся подробнее на работе американцев из Университета Калифорнии, калифорнийского института Солка и нескольких других научных учреждений [3]. В их эксперименте библиотека киРНК была предварительно нанесена на матрицу лунок лабораторной плашки, в которых предстояло развиваться культуре клеток легочного эпителия человека А549, заражённой модифицированным вирусом гриппа штамма A/WSN/33. Фактически, в каждой лунке находились клетки, в которых по принципу РНК-интерференции был «выключен» тот или иной ген (всего около 19000 — практически каждый ген в геноме человека). Для удобного наблюдения за процессом инфекции в формате микроматрицы ген гемагглютинина был заменён на ген люциферазы, что обеспечивает удобство считывания информации о прогрессе инфекции по флуоресцентному сигналу (рис. 2). Однако такой рекомбинантный вирус неспособен полностью пройти весь свой клеточный цикл, — так что основное внимание уделялось проникновению частиц в клетку, высвобождению вирусного генома и генетическим процессам, но не сборке или выходу частиц вируса из клетки.
Анализ скорости развития вируса в клетках с тем или иным «выключенным» геном позволил идентифицировать 295 генов человека, участвующих в развитии вируса: каждый из них, будучи инактивированным, замедлял процесс на 35% и более, или вообще останавливал инфекцию. Многие из этих генов являются «старыми знакомыми» в истории с вирусом гриппа, но большинство «ранее в порочащих их связях замечены не были».
Среди этих генов особенно богато представлены группы сигнальных молекул (участников пути PI3K/AKT), регуляторов динамики цитоскелета, белки, участвующие в фосфорилировании и убиквитилировании [5] других белковых молекул, белки-коатомеры везикул комплекса Гольджи (COPI) и другие (рис. 2г). 53 гена из этого списка «двурушничают» и в пользу других РНК-содержащих вирусов, что говорит об определённой общности механизмов их жизненного цикла. Найденные гены проверили и на вирусе дикого типа, с нормальным гемагглютинином: 219 генов из списка подтвердили то, что они «не чисты на руку». Дополнительная проверка показала, что пособничество 23 генов человека требуются вирусу ещё на стадии проникновения в клетку. Не остался без внимания и вирус свиного гриппа (A/Netherlands/602/2009 h2N1), для которого составили список из 12 генов, ингибирование активности которых подавляло развитие инфекции.
Учёные выдвинули гипотезу, что для борьбы с вирусом гриппа — в том числе, вирусом свиного происхождения, — могут быть полезны ингибиторы некоторых белков человека, например рецептора фактора роста фибробластов FGFR4, вакуолярной АТФазы, киназы гликогенсинтазы GSK3β и некоторых других.
Картирование взаимодействия вирусов с человеческими клетками открывает картину потрясающей сложности там, где ещё несколько лет назад никто и не предполагал ничего подобного. С одной стороны, это осложняет понимание всего процесса, но с другой — указывает новые возможности для того, чтобы сделать вирусу — названому гостю в наших организмах — «подножку». Ведь чтобы «увернуться» от сегодняшних противовирусных лекарств, ему достаточно лишь случайно измениться самому (точнее, изменить всего один или два белка), но антивирусные стратегии завтрашнего дня могут «перекрыть кислород» гораздо более основательно, сделав невозможным взаимодействие с внутриклеточными «предателями», без которого захватчик станет совершенно беспомощным.
- Объяснена различная вирулентность вирусов гриппа — возбудителей «испанки»;
- Подножка для вируса СПИДа;
- Renate König, Silke Stertz, Yingyao Zhou, Atsushi Inoue, H. -Heinrich Hoffmann, et. al.. (2010). Human host factors required for influenza virus replication. Nature. 463, 813-817;
- Alexander Karlas, Nikolaus Machuy, Yujin Shin, Klaus-Peter Pleissner, Anita Artarini, et. al.. (2010). Genome-wide RNAi screen identifies human host factors crucial for influenza virus replication. Nature. 463, 818-822;
- «Вездесущий убиквитин» возвращается.
- М.П. Киселева, З.С. Смирнова, Л.М. Борисова и др. Поиск новых противоопухолевых соединений среди производных N-гликозидов индоло[2,3-а] карбазолов // Российский онкологический журнал. 2015. № 1. С. 33-37.
- Мирский, «Медицина России X—XX веков» (Москва, РОССПЭН, 2005, 632 с.).
- https://rg.ru/2020/04/06/virusolog-obiasnil-pochemu-novyj-virus-okazalsia-shokom-dlia-chelovechestva.html.
- https://biomolecula.ru/articles/molekuliarnoe-dvurushnichestvo-geny-cheloveka-rabotaiut-na-virus-grippa.
- Debjit B., Rishab B., Darsh G., Parshuram R., Sampath K. P. K. Gastroretentive drug delivery systems- a novel approaches of control drug delivery systems. Research Journal of Science and Technology;10(2): 145–156. DOI: 10.5958/2349-2988.2018.00022.0.
- З.С. Смирнова, Л.М. Борисова, М.П. Киселева и др. Противоопухолевая активность соединения ЛХС-1208 (N-гликозилированные производные индоло[2,3-а]карбазола) // Российский биотерапевтический журнал 2010. № 1. С. 80.