Приказ Минсельхоза РФ от 03.04.2006 N 105
Об утверждении Ветеринарных правил лабораторной диагностики гриппа a птиц
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРИКАЗ
от 3 апреля 2006 г. N 105
ОБ УТВЕРЖДЕНИИ ВЕТЕРИНАРНЫХ ПРАВИЛ
ЛАБОРАТОРНОЙ ДИАГНОСТИКИ ГРИППА A ПТИЦ
В целях повышения эффективности борьбы с гриппом птиц и в соответствии с пунктом 5.2.11 Положения о Министерстве сельского хозяйства Российской Федерации, утвержденного Постановлением Правительства Российской Федерации от 24 марта 2006 г. N 164 (Собрание законодательства Российской Федерации, 2006, N 14, ст. 1543), приказываю:
утвердить Ветеринарные правила лабораторной диагностики гриппа A птиц согласно приложению.
Министр
А.В.ГОРДЕЕВ
Приложение
к Приказу Минсельхоза России
от 3 апреля 2006 г. N 105
ВЕТЕРИНАРНЫЕ ПРАВИЛА
ЛАБОРАТОРНОЙ ДИАГНОСТИКИ ГРИППА A ПТИЦ
1. Область применения
1.1. Настоящие Правила устанавливают обязательные требования к организации лабораторной диагностики гриппа A птиц (далее — грипп птиц).
1.2. Положения настоящих правил обязательны для выполнения на территории Российской Федерации органами государственной власти, предприятиями или иными хозяйствующими субъектами, учреждениями, организациями, общественными объединениями, независимо от их подчинения и форм собственности, должностными лицами и гражданами.
2. Общие положения
2.1. Диагностические лабораторные исследования и серологические тесты по определению напряженности поствакцинального иммунитета (далее — лабораторные тесты) проводят в специализированных ветеринарных учреждениях.
2.2. Лабораторная диагностика гриппа птиц направлена на выявление в исследуемых объектах ветеринарного надзора:
вируса гриппа птиц;
РНК вируса гриппа птиц;
антигенов вируса гриппа птиц;
антител к вирусу гриппа птиц.
2.3. При проведении лабораторных тестов могут быть использованы методы лабораторных исследований, применяющие:
тесты, утвержденные в установленном порядке;
тесты, которые реализуются с использованием тест-систем, зарегистрированных в установленном порядке в Российской Федерации.
3. Обязательные требования по отбору проб
для проведения диагностики гриппа птиц
3.1. Отбор проб крови и патологического материала проводит ветеринарный работник, имеющий специальную подготовку.
3.2. Пробы маркируются и опечатываются. К пробам прилагается сопроводительный документ, содержащий сведения о дате и месте отбора проб, юридическом или физическом лице — владельце птицы и месте его нахождения, виде, возрасте птицы и ее состоянии на момент отбора проб.
3.3. Для проведения исследований осуществляют отбор проб патологического материала (органы, ткани головного мозга, легких, трахеи, селезенки, участков кишечника, почек, сердца) от павшей или убитой с диагностической целью птицы.
3.4. От каждого стада птицы отбирают для исследований 5 — 10 трупов или патологический материал от 5 — 10 трупов, клоакальные и/или трахеальные смывы от 10 — 15 голов, 1 — 10 сборных проб помета от стада.
У мелких видов птиц для отбора проб используют свежий помет.
Пробу помета рекомендуется отбирать из расчета 1 грамм помета на 60 точек птичника (выгула или вольеры), выбранных по диагонали крест-накрест.
3.5. Пробы крови для определения антител к вирусу гриппа птиц рекомендуется отбирать у 25 — 30 птиц из стада (партии), из одного птичника (зала) или одного населенного пункта, местности (водоема).
Пробы крови отбирают из подкрыльцовой вены в пробирки, увлажненные физиологическим раствором. Кровь выдерживают до образования сгустка при комнатной температуре или в термостате при 37 град. C в течение 1 — 2 часов, затем обводят иглой или пастеровской пипеткой, отслаивая сгусток крови от стенок пробирки, и оставляют на 16 — 18 часов при температуре 2 — 4 град. C. Образовавшуюся прозрачную без признаков гемолиза сыворотку отбирают с помощью пипетки в отдельные, чистые пробирки.
Отбор крови допускается проводить с помощью иглы и шприца (или вакуумной пробирки).
Рекомендуется проводить центрифугирование проб крови для получения сыворотки в течение 10 — 15 минут при 1000 об./мин. для осаждения свободных эритроцитов.
Для серодиагностики используют парные пробы сывороток крови, полученные от больных или инфицированных птиц, в начале заболевания и через 4 — 10 дней.
3.6. Пробы транспортируются во влагонепроницаемой таре, в контейнере с хладоэлементами или в термосе со льдом. Допускается однократное замораживание сывороток.
При транспортировке проб соблюдают установленные ветеринарно-санитарные правила и меры безопасности, предъявляемые к транспортировке биологических материалов, содержащих инфекционные агенты 3-й группы патогенности.
3.7. Если немедленное исследование проб невозможно, допускается сохранять образцы на протяжении 4 дней при температуре 4 град. C.
При необходимости для увеличения срока хранения диагностические образцы и/или изолят помещают в морозильную камеру с температурой -80 град. C.
4. Методы и сроки проведения лабораторных исследований
4.1. Для установления диагноза на грипп птиц допускается применение следующих методов:
а) для выявления вируса гриппа птиц — биопроба на СПФ (свободных от патогенной микрофлоры) — цыплятах с обязательным последующим подтверждением специфичности биологической реакции;
б) для выделения вируса гриппа птиц — метод выделения вируса на СПФ — куриных эмбрионах или в культуре клеток;
в) для обнаружения антигенов вируса гриппа птиц;
иммуноферментный анализ (ИФА) для обнаружения одного или нескольких белков вируса;
иммунопреципитация (двойная иммунодиффузия по Оухтерлони (далее — РДП) или иммуноэлектроосмофорез (далее — ИЭОФ);
иммунохроматографические методы (далее — ИХА);
радиоиммунный анализ (далее — РИА);
непрямая гем- и латексагглютинация;
реакция связывания комплемента (далее — РСК);
г) для обнаружения гемагглютинина (гемагглютинирующей активности) вируса гриппа птиц:
реакция гемагглютинации (далее — РГА) с подтверждением специфичности в реакции торможения гемагглютинации (РТГА);
ИФА на основе моноспецифических сывороток или моноклональных антител к вирусному гемагглютинину;
д) для обнаружения РНК вируса:
полимеразная цепная реакция (далее — ПЦР);
ПЦР с последующим секвенированием ее продуктов;
Дот-блот и блот гибридизация нуклеиновых кислот;
е) для обнаружения антител к вирусу гриппа птиц:
ИФА;
РДП и ИЭОФ;
ИХА;
РИА;
РТГА;
РСК;
ж) для субтипирования вируса по гемагглютинину и нейраминидазе:
РТГА;
сиквенс к ДНК или ПЦР-продукта;
ПЦР;
Дот-блот и блот гибридизация нуклеиновых кислот;
ИФА на основе моноспецифических сывороток или моноклональных антител к вирусному гемагглютинину;
з) для субтипирования противовирусных антител по гемагглютинину:
РТГА;
ИФА на основе моноспецифических сывороток или моноклональных антител к вирусному гемагглютинину.
4.2. Применение иных тестов допускается для получения предварительных результатов.
4.3. Методы проведения лабораторных исследований реализуются на основе утверждаемых в установленном порядке методик проведения обязательных диагностических исследований.
4.4. Сроки проведения лабораторных исследований устанавливаются в зависимости от метода исследования и не могут превышать 1 месяца.
Поставить диагноз на грипп птиц можно путём выделения вируса и идентификации его в РСК, РН и РТГА, а также выявления специфических AT в процессе эпизоотии или по прошествии её (ретроспективная диагностика). В нашей стране биопромышленность выпускает 2 диагностических набора:
а) набор специфических АГ и сывороток к ним для диагностики гриппа птиц 13-и серотипов;
б) диагностический набор для идентификации вируса НБ и Ш (актуального эпизоотического типа).
Выделение вируса. Взятие и подготовка материала. В качестве вируссодержащего материала используют селезёнку, головной мозг, синусы, трахею, лёгкие, воздухоносные мешки, кишечник от больной птицы или свежих трупов. Материал в лабораторию доставляют в замороженном виде в термосе со льдом. Инфекционные титры вируса в назальных смывах бывают максимальными через 2-4 дня после заражения птицы и достигают 105-107 ЭИДзо/мл смыва. Изолировать вирусы из клоачных смывов удаётся чаще всего на 5-8-й день после экспериментального заражения птицы.
Заражение куриных эмбрионов. Испытуемую суспензию инокулируют 9-10-дн КЭ (не менее 5 на одну пробу) в аллантоисную или амниотическую (лучше) полости общепринятым методом и инкубируют в течение 72 ч. Экстраэмбриональную жидкость каждого эмбриона раздельно проверяют на ГА-активность капельной РГА с 1 %-ной взвесью эритроцитов кур. При отсутствии положительной РГА проводят еще 3-5 слепых пассажей, используя для заражения КЭ эмбриональную жидкость предыдущего пассажа. Если титры ГА низкие, проводят таким же образом еще 2-3 дополнительных пассажа. Проба испытуемого материала считается отрицательной, если в 3-5 слепых пассажах не будет обнаружено ГА и патогенного действия вируса (гибели КЭ). При положительной РГА проводят идентификацию выделенного вируса.
Заражение культуры клеток. Вирус после 2-5 пассажей хорошо развивается в культуре фибробластов КЭ. ЦПД обычно проявляется через 24-48 ч (в зависимости от дозы и адаптации). Присутствие его устанавливают при помощи РГА и РГАд. Предложен ускоренный метод титрования инфекционности вируса гриппа в культуре клеток путем подсчета гемадсорбирующих клеток. Метод позволяет получить результат через 8 ч после заражения.
Биопроба на цыплятах. Испытуемую суспензию инокулируют цыплятам 2-3-месячного возраста. Летальную инфекцию у цыплят можно вызвать при любом методе заражения (подкожно, внутримышечно, в мозг, конъюнктиву) подтипами А1, А7 и А5. Заражение per os с кормом и водой удается непостоянно, лишь в случае высокой патогенности эпизоотического изолята гриппа. Зараженные цыплята, как правило, гибнут через 36-72 ч в зависимости от дозы и вирулентности возбудителя.
Индикация и идентификация вируса. Для этой цели широко используют методы ИФ, цитоскопию, биопробу (на птице и КЭ) и серологическую идентификацию. С помощью монАТ можно идентифицировать не только разные группы вирусов (ВГП и ПМВ), но и определять подтипы ВГП и серотипы ПМВ птиц, и даже штаммы внутри одного подтипа, а также локализацию компонентов вириона в зараженных клетках (МРВГП — МА клонов 1С6, 5С10, N:2 — МА клоны 303 и т.д.). На основе монАТ можно готовить диагностические препараты для выявления АГ и AT в РТГА, НИФ, РСК, ИФА и др. реакциях.
РГА. Для индикации вируса в патологическом материале можно использовать РГА. Надосадочную жидкость после центрифугирования суспензии проб из органов и тканей больной птицы, а также смывов исследуют в капельной или пробирочной РГА с 1%-ной суспензией эритроцитов кур или 0,5%-ной взвесью эритроцитов морской свинки. Реакцию учитывают через 20 мин и 1 ч. Специфичность определяют в РТГА.
Цитоскопия. Метод заключается в исследовании тканевых элементов в отпечатках, полученных со слизистой оболочки верхних дыхательных путей (лучше) и органов. Препараты высушивают и окрашивают одним из методов: по Романовскому, Пигаревскому, Быковскому и т. п. При окраске по Быковскому и Пигаревскому в цитоплазме клеток при гриппе обычно обнаруживают тельца-включения ярко-красного цвета; при окраске по Романовскому — фиолетового цвета. Внутриклеточные включения находят не только в клетках цилиндрического эпителия, но и в цитоплазме макрофагов, лейкоцитов и плоского эпителия. В настоящее время этот принцип исследования используется с применением люминесцентной микроскопии.
Метод простого флюорохромирования. На мазки-отпечатки из органов и смывов наносят 1-2 капли рабочего раствора акридина оранжевого (1:10000), покрывают покровным стеклом и свежий препарат (в течение 10 мин после приготовления) рассматривают в люминесцентном микроскопе. Ядра клеток выявляются по изумрудно-зеленому свечению, РНК плазмы клеток — в виде не резко ограниченных гранул красного или оранжевого цвета. В препарате, имеющем вирус гриппа, выявляются включения в виде четко отграниченных ярко-красных гранул в цитоплазме клеток.
Серологическая идентификация
Для идентификации гриппа млекопитающих и птиц наиболее простым и высоко достоверным методом является РТГА. РН — штаммоспецифическая и также высоко достоверная, но используется в диагностике значительно реже. Ее обычно применяют при некоторых неясных и спорных случаях.
Реакция связывания комплемента. Используют для определения типоспецифичности выделенного вируса, когда в РТГА не удается установить родственных связей между выделенным и эталонными штаммами вируса гриппа по антисывороткам к ним. В этом случае в РСК с эталонными иммунными сыворотками против вирусов гриппа типов А, В и С устанавливают типовую принадлежность штамма.
В последнее время для типирования нейраминидазы вируса начали применять РТНА, но в диагностической ветеринарной практике она пока еще не применяется. Ее используют, в основном, для изучения АГ связей различных штаммов вируса гриппа.
Реакция торможения гемагглютинации. Идентификацию испытуемого вируса проводят с набором эталонных штаммоспецифических гриппозных сывороток к его АГ вариантам. Для дифференциации в реакцию вводят сыворотку против вируса НБ. РТГА ставят микро- или макрометодом по общепринятой методике.
Иммуноферментный метод. Может быть использована как экспресс-метод диагностики гриппа птиц. Препараты готовят непосредственно ex tempore от убитой больной или свежепавшей птицы. Прямой метод ИФ позволяет определять АГ ВГП в мазках-отпечатках тканей птиц, идентифицировать АГ данного вируса из различных тканей организма, инкубационных яиц, печени зараженных эмбрионов и культур клеток фибробластов; выявить вирусный АГ даже в тех случаях, когда вирус из пораженных тканей выделить не удается.
В ветеринарной диагностической практике для идентификации выделенного вируса РДП не используют, так как необходимы концентрированные и очищенные АГ. В основном применяют ее для изучения АГ структуры вирусов гриппа. Разработаны наборы для ИФА с монАТ, непосредственно обнаруживающие ГА, нуклеокапсидный или матриксный белки вируса гриппа. Идентификацию вирусспецифической нуклеиновой последовательности предлагается осуществлять ПЦР с 2-мя типами праймеров (на основе генов неструктурного белка и ГА). Тест стандартизован для определения AT к ВГП в сыворотке крови у индеек.
Минимальные АГ различия между вариантами и родительским вирусом выявлялись только монАТ, продуцируемыми клетками гибридомы PEG-1 или фрагментами селезенки гипериммунных животных. МонАТ дают возможность точно проследить филогенетические взаимоотношения между вирусными штаммами в составе субтипа, а в сочетании с методами пептидного картирования и определения последовательности а.к. — выяснить молекулярную структуру АГ участка ГА.
Серодиагностика и ретроспективная диагностика. Обнаружение анти-ГА, ВНА и КСА — надежный признак протекающей или уже прошедшей инфекции ГП в стаде.
РТГА. Исследование парных сывороток проводят с диагностической целью при атипичном, часто вялом течении болезни с поражением органов дыхания. Сыворотку от диких птиц на присутствие противогриппозных AT исследуют при изучении роли перелетных птиц в распространении гриппа. Обязательным условием для ретроспективной диагностики ГП является одновременное исследование парных сывороток, так как для диагностических целей имеет значение сравнительный титр AT против вирусов различных серологических подтипов в 1-й и 2-й пробах сыворотки. Первую пробу сыворотки хранят при 4°С или в замороженном виде. Обе пробы исследуют одновременно. Перед постановкой реакций сыворотки прогревают при 60°С 30 мин, а затем освобождают от термостабильных ингибиторов, используя СО2, КО4 и др. методы. Если титр AT во 2-й пробе сыворотки (через 10-14 дн после заболевания) превышает не менее чем в 4 раза титр AT к тому же типу вируса в 1-й пробе, то РТГА считается положительной, подтверждающей диагноз гриппа птиц. При постановке РТГА с парными сыворотками больных птиц необходимо использовать не только набор эталонных штаммов (например, к вирусам A/Fowl plague, A/Chick/Scotland, A/Turkey, A/Duck), но и местные штаммы того птицехозяйства, где зарегистрирована болезнь. При анализе результатов РТГА необходимо указывать, сколько сывороток было с низким, средним и высоким титром к тому или иному штамму вируса гриппа. В ряде случаев вместо индивидуальных сывороток показатели иммунитета стада (после переболевания или прививки живой вакциной) можно изучить на сыворотках,.полученных от нескольких птиц. В этих случаях испытуемые сыворотки, взятые от отдельных птиц, нужно соединять в равных объемах. На протяжении опыта (120 дн после реконвалесценции) в сыворотках кур находили анти-ГА: до 75-го дня титры сохранялись примерно на одном уровне (5-5,8 log2), а в дальнейшем снижались (до 4,4-4,6 log2).
РСК применяют для обнаружения АГ и AT в целях ранней и ретроспективной диагностики гриппа. Ставят с аллантоисными жидкостями КЭ или с очищенными диагностикумами. РДП широкого применения не нашла, так как необходимы высокие концентрации чистых АГ. Среди исследователей нет единого мнения о чувствительности этой реакции. Некоторые авторы указывают, что чувствительность РДП сравнительно невысока, поскольку достоверные положительные результаты получали лишь при исследовании сывороток с титром AT в РТГА 1:80 и выше.
Реакция радиального гемолиза. В настоящее время используется для сероэпидемиологических исследований и при оценке эффективности противогриппозных вакцин. РРГ с ВГ А обладает выраженной штаммовой специфичностью: диаметр зон гемолиза с гомологичными АГ при исследовании сывороток хорьков, зараженных 6-ю различными вирусами, были в 1,5-3 раза больше, чем с гетерологичными. При правильном подборе штамма РРГ может быть с успехом использована для определения анти-ГА.
Показано хорошее совпадение результатов титрования AT в ELISA, РСК и ИФ. Однако в ELISA значительно выше (титр 1:481-1:1520), чем в РСК и РИФ. Сенсибилизацию лунок панелей проводят РНК-АГ вируса гриппа А. Предложен новый метод приготовления AT эритроцитарных диагностикумов к вирусам гриппа, которые с успехом могут быть изготовлены на основе любых штаммов вируса гриппа. Они позволяют определять типовую принадлежность эпизоотических и межэпизоотических штаммов ВГП, свиней и лошадей. В практической работе врачу ветеринарной лаборатории, возможно, придется встретиться не только с гриппом кур и уток, но и с гриппом индеек.
Таблица 107 — Лабораторные методы дифференциации гриппа и ньюкаслской болези птиц
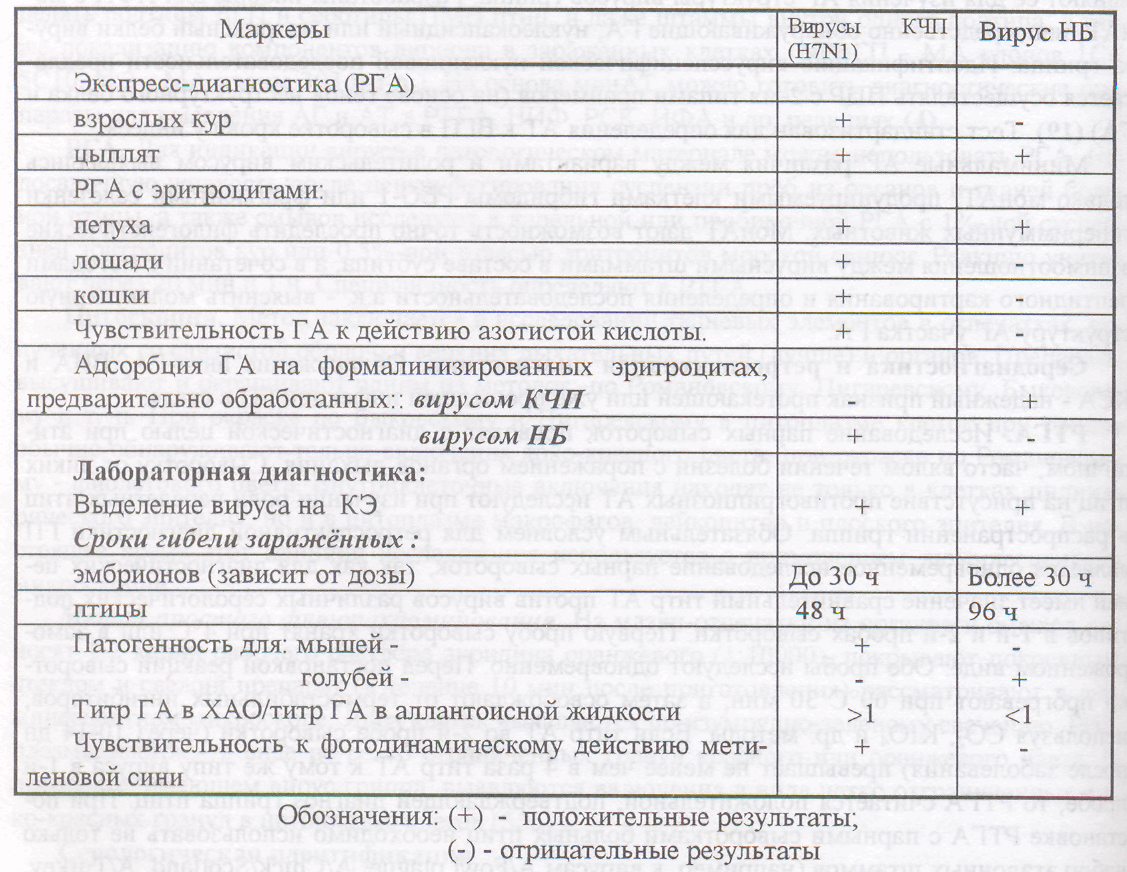
Умея диагностировать грипп кур и уток, имея набор диагностикумов, врач лаборатории при необходимости сможет поставить диагноз при гриппозной инфекции индеек.
При респираторных вирусных болезнях КРС, свиней и птиц (грипп, парагрипп, РС-инфекция) разработан направленный тест. Это новый иммуноферментный мембранный тест быстрого обнаружения вирусов гриппа в носоглоточных смывах. Чувствительность направленного метода Flu-А составляла 90%. С помощью этого теста более легко обнаруживается клеточно-ассоциированный АГ, присутствующий в клинических пробах, чем свободный вирус. С помощью Flu-А теста удалось обнаружить вирусы гриппа А птиц (субтипы ГА Н3 и Н6) и свиней (h2N1) в клоачных смывах и гомогенатах.
Дифференциальная диагностика. КЧП (H7N1) и другие формы гриппа птиц следует отличать от НБ, ИБ, ИЛТ, гемофилеза и респираторного микоплазмоза. Для идентификации вирусов НБ и КЧП используется диагностический набор.
В сомнительных случаях для дифференциального диагноза ставят РН на КЭ и заражают птиц, иммунных к вирусу НБ.
Лабораторная диагностика гриппа свиней
Грипп свиней (инфлюэнца свиней, энзоотическая бронхопневмония) — высоко контагиозная, остро протекающая болезнь, возникающая в холодное время года и характеризующаяся внезапным началом, резко выраженной лихорадкой, общей слабостью и поражением органов дыхания. Вирус гриппа свиней (ВГС) может вызвать заболевание людей и, наоборот, установлена возможность заражения свиней вирусом гриппа человека.
Болезнь впервые диагностирована в США в 1918 г. во время пандемии гриппа людей. Встречается во многих странах Европы и Америки, зарегистрирована и в бывшем СССР В отдельных хозяйствах причиняет большой экономический ущерб. Описана вспышка гриппа среди 115 свиноматок, вызванная «новым типом» вируса гриппа H3N2, который появился в Дании в 1990 г. Степень опоросов сократилась с 90 до 43% — через 14 дн после появления заболевания. Снизилось количество новорожденных поросят.
Выделение вируса. Выделение вируса на лабораторных животных. Используют хорьков, белых крыс, но чаще белых мышей. В качестве исходного материала для выделения вируса используют кусочки лёгкого, трахеи, бронхиальный экссудат, носовые смывы от больных свиней.
Мышей заражают интразально под эфирным наркозом и в течение 5- 7 дн наблюдают за ними, обращая внимание на общее состояние животных. Если животные не гибнут, их убивают. На вскрытии отмечают изменения в лёгких. Затем проводят ещё 3-4 пассажа. По мере адаптации вирулентность вируса для белых мышей значительно возрастает, они гибнут на 4-7-й, а иногда на 14-й день после заражения.
Выделение вируса на КЭ. Испытуемый материал инокулируют в аллантоисную или амниотическую полости 9-12-сут КЭ, которые после заражения инкубируют 48-72 ч, иногда до 96 ч при температуре 37°С. Для выделения вируса обычно проводят 2-3 слепых пассажа.
Выделение вируса в культуре клеток. Культура клеток почек поросёнка — универсальная биологическая система, применяя которую можно выделить вирус от больных свиней. Для быстрой индикации вируса гриппа в 1-слойных культурах почечного эпителия поросят используют РГАД с эритроцитами курицы, морской свинки или 0-группы человека. ГАд, положительная РГА, а также дегенеративные изменения клеток указывают на присутствие вируса в исследуемом материале. Вирус, вызвавший явление ГАд, должен адаптироваться к КЭ и вызывать накопление ГА.
Риноцитоскопия. Со слизистой оболочки носа делают мазки-отпечатки. Положительный диагноз ставят на основании обнаружения в отпечатке в первые 1-3 дн болезни большого количества клеток цилиндрического эпителия. Позднее содержание цилиндрических клеток в мазке уменьшается. Вопрос о диагностическом значении цитоплазматических включений при гриппе свиней неясен; в литературе нет достаточно обоснованных сообщений.
Обнаружение вируса в РГА. При постановке РГА обычно используют эритроциты кур или морской свинки. Берут 0,5 мл носового смыва, добавляют 0,5 мл 0,5%-ной взвеси эритроцитов, тщательно встряхивают и оставляют при комнатной температуре на 1-2 ч. Результаты реакции учитывают общепринятым методом. Чувствительность реакции можно повысить, увеличив объем испытуемых смывов. РГА со смывами используют только при массовом заболевании гриппом, так как процент специфических реакций не превышает 30.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- Haeser, «Handbuch der Gesch. d. Medicin».
- Daremberg, «Histoire des sciences médicales» (П., 1966).
- Bangun H., Aulia F., Arianto A., Nainggolan M. Preparation of mucoadhesive gastroretentive drug delivery system of alginate beads containing turmeric extract and anti-gastric ulcer activity. Asian Journal of Pharmaceutical and Clinical Research. 2019; 12(1):316–320. DOI: 10.22159/ajpcr.2019.v12i1.29715.
- https://legalacts.ru/doc/prikaz-minselkhoza-rf-ot-03042006-n-105/.
- https://studfile.net/preview/6054934/page:50/.
- М.П. Киселева, З.С. Смирнова, Л.М. Борисова и др. Поиск новых противоопухолевых соединений среди производных N-гликозидов индоло[2,3-а] карбазолов // Российский онкологический журнал. 2015. № 1. С. 33-37.