РНК-полимераза вируса гриппа: новое уязвимое место
Французские ученые исследовали механизмы коэволюции субъединиц РНК-зависимой РНК-полимеразы вируса гриппа А. Оказалось, что для функционирования вируса важно не только взаимодействие между субъединицами, но и образование олигомеров полимеразы, в частности, димеров. Воздействие на это свойство полимеразы можно положить в основу антивирусной терапии.
Изображение:
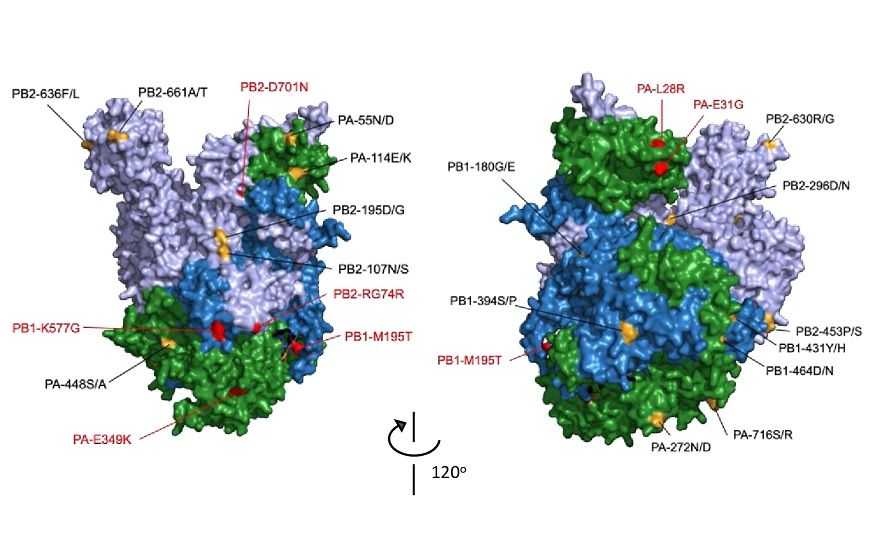
Полимераза вируса гриппа — гетеротример. Субъединицы показаны разными цветами, отмечены аминокислоты, затронутые мутациями. Credit: PLOS Pathogens, 2019; 15 (10): e1008034; DOI: 10.1371/journal.ppat.1008034 | CC BY 4.0
Ежегодные эпидемии гриппа подталкивают исследователей к поиску новых вакцин и лекарств. В новой статье, опубликованной в PLOS Pathogens, были изучены некоторые механизмы взаимодействия между субъединицами вирусной полимеразы, влияющие на эффективность ее работы.
Геном вируса гриппа А состоит из восьми одноцепочечных фрагментов антисмысловой РНК, каждый из которых связан с тремя субъединицами (PB2, PB1 и PA) РНК-зависимой РНК-полимеразы, образующими гетеротример. Без полимеразы гриппа невозможна репликация генома вируса, так как подобного фермента нет в клетках хозяина, поэтому РНК-зависимая РНК-полимераза представляет интерес как потенциальная мишень для лекарств против вируса гриппа.
Ранее было показано, что полимеразные гетеротримеры могут взаимодействовать между собой, образуя олигомеры, и получена кристаллическая структура димера полимеразы (комплекса двух гетеротримеров). Однако оставалось неясным, является ли такое состояние функциональным, кроме того, механизмы взаимодействия между субъединицами полимеразы PB2, PB1 и PA не были детально изучены.
Чтобы исследовать эти вопросы, авторы работы, опубликованной в PLOS Pathogens, использовали явление реассортации — обмен сегментами генома между разными вирусами; реассортация происходит и в природных условиях при заражении организма двумя штаммами одновременно и повышает изменчивость вирусов. Они создали новый штамм вируса, который получил геномный сегмент, кодирующий белок PB2, от лабораторного штамма A/WSN/33 (WSN), а все остальные сегменты — от штамма A/PR/8/34 (PR8). Несмотря на высокую гомологию PB2 из вирусов двух штаммов (97%), эффективность заражения гибридным вирусом резко снизилась, а уровень димеризации полимеразы повысился. Однако через несколько поколений у потомков гибридного вируса возникали мутации в белках-субъединицах полимеразы. Благодаря этим мутациям возросла активность полимеразы, причем возрастание активности коррелировало со снижением уровня димеризации. Вероятно, это явление связано с оптимальным балансом между различными формами полимеразы.
Следовательно, димеризация вирусной полимеразы важна для эффективной репликации генома. Кроме того, три субъединицы полимеразы коэволюционируют и коэволюция оптимизирует не только их взаимодействия в составе гетеротримера, но и димеризацию. Авторы отмечают, что изменения в способности полимеразы образовывать димеры могут ограничивать реассортацию штаммов. Они также делают вывод, что участки субъединиц полимеразы, отвечающие за димеризацию, — перспективная мишень противовирусных лекарственных препаратов.
Источник
Chen K.-Y., et al. // Influenza virus polymerase subunits co-evolve to ensure proper levels of dimerization of the heterotrimer. // PLOS Pathogens, 2019; 15 (10): e1008034 DOI: 10.1371/journal.ppat.1008034
Среди возбудителей острых респираторных заболеваний эти наиболее многочисленны. Грипп вызывают более 2000 штаммов семейства ортомиксовирусов, различных по контагиозности и тяжести клинического течения.
Содержание:
Строение вирусов
Можно ли определить вирусы гриппа по симптомам
Зачем нужно сдавать анализы на грипп
Как проводят анализы на наличие гриппа
Строение вирусов
Размеры возбудителей гриппа микроскопичны. Целые вирионы меньше 1 мм в диаметре почти в 1000 раз. Они имеют сферическую форму. Наружная оболочка — капсид, состоит из липидов с белковыми антигенами: гемагглютинином и нейраминидазой. С их помощью патоген «прилипает» к белкам на поверхности человеческих клеток, внедряется в них и выходит наружу.
Внутренний нуклеопротеид вируса покрывает геном — цепочку РНК. Выделяют 3 основных их типа, условно обозначая А, В и С. Первый считается самым распространенным, вызывает наиболее тяжелые симптомы. К этому типу относились знаменитые «испанка», Гонконгский и «свиной» штаммы. Вирусы В встречаются несколько реже. Заболеваемость гриппом С наименее распространена.
У всех возбудителей строение нуклеопротеидов неизменно, но нейраминидаза и гемагглютинин регулярно мутируют. Изменчивость антигенов обеспечивает инфекции формирование новых штаммов и сохранение поражающей способности от сезона к сезону. Так называемый антигенный дрейф делает невозможным формирование длительного иммунитета от гриппа.
Обозначения штаммов содержат основную информацию о геноме:
тип нуклеопротеида: (А, В или С);
строение гемагглютинина: (буква H с числом);
строение нейраминидазы (буква N с номером).
Например, пресловутый свиной грипп обозначают как А(h2N1). Кроме того, в расширенном обозначении указывают год и регион выявления штамма.
Свойство мутировать позволяет человеческим вирусам обмениваться белками с дикими патогенами и образовывать новые формы. Это происходит приблизительно каждые 10-40 лет. Гибриды вирусов животных и людей отличаются высочайшей патогенностью и заразностью, провоцируя масштабные пандемии.
Можно ли определить вирусы гриппы по симптомам
Клиническая картина при гриппе отличается от других ОРВИ. У этой болезни очень короткий продромальный период, так как инфекция внедряется в организм и размножается стремительно. Симптомы развиваются спустя несколько часов или сутки с момента заражения. Грипп практически сразу вызывает резкий подъем температуры, мышечную слабость, сильную головную боль. Мокрый кашель и насморк для него нехарактерны, но чаще, чем при ОРЗ, возникают конъюнктивит, бронхит и пневмония.
Многие врачи ставят диагноз больным по имеющимся симптомам, однако без уточнения, какой возбудитель спровоцировал болезнь. В заключении указывают ОРВИ. Определить тип и штамм инфекции возможно только в лабораторных условиях.
Зачем нужно сдавать анализы на грипп
Специфическая диагностика необходима для выявления и изучения новых штаммов вирусов, скорости их распространения, мутирования, для прогнозирования эпидемиологической обстановки в регионах, улучшения качества лечения. Без ее проведения больным неоправдано назначение по-настоящему эффективных противовирусных медикаментов: препараты озельтамивира и занамивира. Они подавляют активность штаммов А — самого распространенного типа. Но почти не действуют при серотипах В и С. Кроме того, ослабление имммунитета часто провоцирует присоединение вторичных бактериальных инфекций, требующих дополнительного применения антибиотиков.
Назначение медикаментов вслепую затягивает время, в течение которого больному могла бы быть оказана другая помощь. По этим причинам были разработаны несколько принципиально различных видов диагностики.
Как проводят тестирование на наличие гриппа
Для исследование необходим биоматериал больного: соскобы и мазки со слизистых носоглотки. Реже РНК вируса выделяют из крови или спинномозговой жидкости. Высокую точность обеспечивает тестирование свежих проб: не позднее третьих суток с момента появления симптомов.
Для быстрого определения серотипов применяются экспресс-методы диагностики:
иммунохроматографический (ИХА): клетки биоматериала помещаются в тестовую систему с реагентами, в течение 10 минут имеющиеся ключевые антигены избирательно связываются со специфическими антителами;
прямая реакция иммунофлюоресценции: на культуры исследуемых клеток наносят люминесцентный состав, выявляющий маркеры инфекции, через 2-3 часа результат изучают в специальный микроскоп.
Более затратным по времени и стоимости является серологический тест ИФА. Специфические антигены серотипов А и В выявляются посредством воздействия комплекса антител. Сцепляясь с белковыми структурами вирусов, они образуют комплексы «антиген-антитело», указывая на наличие инфекции в биоматериале. Результат теста бывает готов в течение суток. Он имеет меньшую погрешность, чем экспресс-методики. Главный недостаток иммуноферментного анализа: невозможность выявить штамм патогена.
Культуральное исследование — посев клеток биоматериала в ткани куриных эмбрионов применяется редко. Этот вид диагностики довольно точен и доступен, но длительность получение результата — до 7 дней, делает его малорациональным.
ПЦР-диагностика (метод полимеразной цепной реакции) наиболее информативна. С ее помощью можно определить серотип и штамм вируса гриппа в течение нескольких часов. Из-за дороговизны оборудования и трудоемкости этот анализ чаще применяется в рамках изучения эпидемических возбудителей. Для качественного исследования в отдельных случаях применяют экспресс-диагностику или ИФА. Дифференциации серотипа А от В и С для врача бывает достаточно, чтобы сориентироваться в выборе медикаментов и схем лечения.
Опубликовано: 30 Октября 2020
Автор
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Influenza virus A/B (вирусы гриппа А/В), РНК [реал-тайм ПЦР]
[09-120] Influenza virus A/B (вирусы гриппа А/В), РНК [реал-тайм ПЦР]
1230 руб.
Выявление вируса гриппа серотипов А и В (Influenza virus A/B), в ходе которого с помощью метода полимеразной цепной реакции в реальном времени (РТ-ПЦР) определяется генетический материал (РНК) вируса в образце биоматериала.
Синонимы русские
Грипп А/В.
Синонимы английские
Influenza serotypes A/B, RNA [real- polymerase chain reaction, RT-PCR, quantitative RT-PCR, qPCR, qRT-PCR].
Метод исследования
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Мазок из зева (ротоглотки) и носа, мокроту.
Как правильно подготовиться к исследованию?
- Рекомендуется употребить большой объем жидкости (воды) за 8-12 часов до сбора мокроты.
- Не принимать пищу, не пить и не полоскать горло в течение 2-3 часов до исследования.
- За 3-4 часа до взятия мазков из ротоглотки (зева) и носа не употреблять пищу, не пить, не чистить зубы, не полоскать рот/горло, не закапывать капли/спреи в нос, не жевать жевательную резинку, не курить. Взятие мазков оптимально выполнять утром, сразу после ночного сна.
Общая информация об исследовании
Influenza virus — это оболочечный вирус, характеризующийся наличием сегментированного негативного РНК-генома и нуклеокапсида в форме спирали. Он относится к семейству Orthomixoviridae. На основании структурных различий нуклеопротеида выделяют 3 серотипа Influenza: A, B и С. Серотип A встречается как людей, так и у животных, в то время как варианты B и C поражают преимущественно людей. Именно серотип А ответственен за подавляющее большинство случаев сезонных (эпидемических) и пандемических вспышек гриппа.
Идентификация вируса гриппа должна быть осуществлена в кратчайшие сроки, что связано с высокой заразностью этого заболевания. Кроме того, эффективность противовирусных препаратов максимальна при их назначении в первые 48 часов после инфицирования, что также диктует необходимость своевременной постановки окончательного диагноза. Среди многих «быстрых» диагностических тестов особое место занимает полимеразная цепная реакция в режиме реального времени (РТ-ПЦР). Полимеразная цепная реакция в реальном времени (РТ-ПЦР) — это метод молекулярной диагностики, позволяющий выявлять в биологическом материале (например, в мокроте) фрагменты генетического материала (РНК) возбудителя инфекции. Благодаря высокой чувствительности и специфичности метода, а также возможности получить результат в наболее короткие сроки, РТ-ПЦР заменила другие, применяемые ранее, методы диагностики гриппа: выделение вируса в культуре клеток, а также серологические исследования и иммуноферментный анализ.
Многие прямые лабораторные тесты, разработанные для идентификации Influenza, основаны на выявлении белковых компонентов наружной оболочки вируса: гемагглютинина (H) и нейраминидазы (N). Эти белки являются основными факторами, определяющими степень болезнетворности вируса, а также используются для диагностики и классификации выявляемого вируса гриппа. Они обладают выраженной изменчивостью (известно 16 разновидностей N и 9 разновидностей H серотипа Influenza A) (чем вызваны ежегодные сезонные вспышки гриппа), а также создает определенные трудности при идентификации вируса гриппа с помощью этих методов. Структурное разнообразие антигенов H и N приводит к тому, что чувствительность большинства прямых лабораторных тестов (таких как прямая иммунофлюоресценция и ELISA) составляет около 65-75 %. Исследование РТ-ПЦР основано на выявлении консервативной последовательности ДНК, общей для разных штаммов вируса гриппа серотипов А и В, что обуславливает максимальную чувствительность этого теста (98-100 %).
В отличие от других тестов, чувствительность исследования РТ-ПЦР практически не изменяется при взятии материала на фоне начатой терапии противовирусными препаратами. Это связано с тем, что в реакции выявляется не сам вирусный агент, а фрагмент вирусной ДНК. По этой же причине положительный результат исследования не всегда указывает на наличие живого вируса (репликацию) и не всегда означает, что пациент остается заразным для окружающих.
В отличие от других лабораторных тестов (в первую очередь, экспресс-тестов для определения антигена вируса гриппа), результат РТ-ПЦР в меньшей степени зависит от распространенности гриппа среди населения. РТ-ПЦР характеризуется редкими ложноположительными и ложноотрицательными результатами как во время эпидемии, так и в период низкой заболеваемости гриппом.
Идентификация вируса гриппа с помощью РТ-ПЦР возможна в течение более длительного времени от начала заболевания по сравнению с большинством других тестов. Тем не менее взятие отделяемого носо/ротоглотки для исследования с помощью РТ-ПЦР должно быть произведено не позднее чем через 72-96 часов (оптимально в первые 48-72 часа). Это связано с тем, что интенсивная репликация Influenza при поражении верхних дыхательных путей происходит в течение первых 4 суток заболевания. У пациентов с вовлечением нижних отделов дыхательных путей вирусная нагрузка сохраняется высокой более длительный период. Исследование отделяемого носоглотки и мокроты дает лучшие результаты по сравнению с исследованием отделяемого ротоглотки.
При обследовании пациента с клиническими признаками Influenza-ассоциированной инфекции верхних дыхательных путей следует выполнить анализ отделяемого носо/ротоглотки. При обследовании пациента с признаками Influenza-ассоциированной инфекции нижних дыхательных путей анализ мазков из зева и носа необходимо дополнить исследованием мокроты. Исследование мокроты также должно быть осуществлено при отрицательном результате, который дал анализ отделяемого верхних дыхательных путей у пациента с клиническими признаками гриппа. Следует повторить РТ-ПЦР при отрицательном результате исследования мокроты у пациента с клиническими признаками Influenza-ассоциированной инфекции нижних дыхательных путей.
Для более точной диагностики Influenza рекомендуется сочетание РТ-ПЦР с дополнительными общеклиническими исследованиями. Кроме того, необходимо исключить бактериальную суперинфекцию.
Для чего используется исследование?
- Для диагностики гриппа.
Когда назначается исследование?
При симптомах:
- острой респираторной вирусной инфекции (внезапное острое начало болезни, лихорадка, боль в горле, боль в мышцах, головная боль, светобоязнь, сухой кашель, боль в грудной клетке, одышка);
- острой энцефалопатии в период эпидемии гриппа (судороги, атаксия, нарушение сознания).
Что означают результаты?
Референсные значения: отрицательно.
Причины положительного результата:
- Influenza-ассоциированная инфекция.
Причины отрицательного результата:
- отсутствие Influenza-ассоциированной инфекции.
Важные замечания
- Положительный результат исследования не означает, что пациент остается заразным для окружающих.
- Анализ не позволяет выявлять Influenza серотипа С.
Также рекомендуется
- Клинический анализ крови: общий анализ, лейкоцитарная формула, СОЭ (с микроскопией мазка крови при выявлении патологических изменений)
- Mycoplasma pneumoniae, ДНК [реал-тайм ПЦР]
- Adenovirus, ДНК [реал-тайм ПЦР]
- Streptococcus pneumoniae, ДНК [реал-тайм ПЦР]
Кто назначает исследование?
Инфекционист, педиатр, врач общей практики, анестезиолог-реаниматолог.
Литература
- Kamps B. S, Hoffmann C, Preiser W. Influenza Report 2006 / B. S. Kamps, С. Hoffmann, W. Preiser W. — Flying Publisher, 2006.
- Wang R, Taubenberger JK. Methods for molecular surveillance of influenza. Expert Rev Anti Infect Ther. 2010 May;8(5):517-27.
- Schuchat A, Bell BP, Redd SC. The science behind preparing and responding to pandemic influenza: the lessons and limits of science. Clin Infect Dis. 2011 Jan 1;52 Suppl 1:S8-12.
- Pregliasco F, Mensi C, Camorali L, Anselmi G. Comparison of RT-PCR with other diagnostic assays for rapid detection of influenza viruses. J Med Virol. 1998 Oct;56(2):168-73.
- WHO Global Influenza Surveillance Network. Manual for the laboratory diagnosis and virological surveillance of influenza. — World Health Organization, 2011.
Грипп A/h2N1 как типичная эмерджентная инфекция: Общая характеристика вирусов гриппа, изменчивость, появление новых пандемических штаммов
Статьи
ГРИПП A/h2N1 КАК ТИПИЧНАЯ ЭМЕРДЖЕНТНАЯ ИНФЕКЦИЯ
Вирусы гриппа — РНК-содержащие вирусы — относятся к сем. Orthomyxoviridae и разделяются на вирусы А, В и С (табл. 1).
Таблица 1.
Сравнительная характеристика вирусов гриппа
| Критерии | Тип А | Тип В | Тип С |
| Тяжесть заболевания | ++++ | ++ | + |
| Природный резервуар | Есть | Нет | Нет |
| Пандемии человека | Вызывает | Не вызывает | Не вызывает |
| Эпидемии человека | Вызывает | Вызывает | Не вызывает (лишь спорадические заболевания) |
| Антигенные изменения | Шифт, дрейф | Дрейф | Дрейф |
| Сегментированный геном | Да | Да | Да |
| Чувствительность к ремантадину | Чувствительны | Не чувствительны | Не чувствительны |
| Чувствительность к занамивиру | Чувствительны | Чувствительны | — |
| Поверхностные гликопротеины | 2 (HA, NA) | 2 (HA, NA) | 1(HA) |
Вирус гриппа имеет сферическую форму и размер 80-120 нм. Сердцевина представлена одноцепочечной отрицательной цепью РНК, состоящей из 8 фрагментов, которые кодируют 11 вирусных белков.
Вирусы гриппа А широко распространены в природе и поражают как людей, так и целый ряд млекопитающих и птиц. Вирусы гриппа типов В и С выделены только от человека.
Эпидемически значимыми являются 2 подтипа вируса гриппа А — H3N2 и h2N1 и вирус гриппа типа В (А.А. Соминова с соавт, 1997; О.М. Литвинова с соавт., 2001). Итогом такой ко-циркуляции явилось развитие в один и тот же эпидсезон в различных странах эпидемий гриппа различной этиологии. Гетерогенность популяции эпидемических вирусов возрастает также за счет дивергентного характера изменчивости вирусов гриппа, что приводит к одновременной циркуляции вирусов, относящихся к различным эволюционным ветвям (О.М. Литвинова с соавт., 2001). В этих условиях создаются предпосылки для одновременного инфицирования человека различными возбудителями, что приводит к формированию смешанных популяций и реассортации как между вирусами ко-циркулирующих подтипов, так и среди штаммов в пределах одного подтипа (О.И. Киселев с соавт., 2000).
Классификация типов вирусов гриппа основана на антигенных различиях двух поверхностных гликопротеинов — гемагглютинина (НА) и нейраминидазы (NА). Согласно этой классификации вирусы гриппа и подразделяют на 3 типа — вирусы гриппа типа А, типа В и типа С. Различаются 16 подтипов НА и 9 подтипов NА.
Рис. 1. Классификация вирусов гриппа А и виды животных и птиц — промежуточные и конечные хозяева в цепи передачи инфекции к человеку.
Недавно открыт 16 подтип (Н16) гемагглютинина
Примечание: ∗ НА 7 и NА 7-NА8 выявили и у лошадей
На рис. 1 представлены подтипы вирусов гриппа типа А и их промежуточные хозяева и природные резервуары (перелетные птицы). К основным хозяевам вирусов гриппа А относятся те виды, которым свойственна заболеваемость гриппом.
В популяции человека до настоящего времени выявлены вирусы гриппа А только трех подтипов с НА1, НА2 и НА3. При этом вирусы содержат только два типа нейраминидазы — NА1 и NА2 (рис.1). Доказана их стабильная циркуляция в течении прошлого столетия, начиная с пандемии 1918 г (R.G. Webster et al., 1978; K.G. Nicholson et al., 2003).
Вирусы гриппа А (в меньшей степени В) обладает способностью к изменению структуры НА и NА. Для вируса гриппа А характерны два типа изменчивости:
- точечные мутации в вирусном геноме с соответствующим изменением в НА и NА (антигенный дрейф);
- полная замена одного или обоих поверхностных гликопротеинов (НА и NА) вируса путем реассортации/рекомбинации (антигенный шифт), в результате которого появляется принципиально новый вариант вируса, способный вызвать гриппозные пандемии.
Для вируса гриппа В антигенная изменчивость ограничивается только дрейфом, т.к. он, по-видимому, не имеет природного резервуара среди птиц и животных. Для вируса гриппа С характерна большая стабильность антигенной структуры и с ним связаны лишь локальные вспышки и спорадические случаи заболевания.
Представляет определенный интерес появление новых штаммов вируса гриппа в человеческой популяции и связанные с ними пандемии (рис. 2). На рис. 2 представлены основные антигенные шифты, ассоциированные с панедмиями ХХ века, вызванные вирусами гриппа А:
- в 1918 г пандемия была вызвана вирусом типа h2N1;
- в 1957 г — H2N2 штаммом А/Singapore/1/57;
- в 1968 г — H3N2 штаммом A/Hong Kong/1/68;
- в 1977 г — h2N1 штаммом A/USSR/1/77 (многие ученые не рассматривали это как пандемию, но с появлением этого штамма сложилась ситуация с одновременной ко-циркуляцией 2 штаммов вируса гриппа А — H3N2 и h2N1).
В 1986 г в Китае вирус А/Тайвань/1/86 вызвал обширную эпидемия гриппа А/h2N1, продолжавшуюся до 1989г. Дрейф варианты этого вируса просуществовали до 1995 г, вызывая локальные вспышки и спорадические случаи заболевания. По результатам молекулярно-биологических исследований в геноме вируса А/h2N1 в эти годы возникли множественные мутации. В 1996 г появились два антигенных варианта вируса гриппа А/h2N1: А/Берн и А/Пекин, их особенностью являлась не только антигенная, но и географическая разобщенность. Так, в России вирус гриппа А/Берн принял активное участие в эпидемии гриппа 1997-98 гг. В этот же сезон на востоке страны была зарегистрирована циркуляция штаммов вируса А/Пекин. В дальнейшем в 2000-2001 гг. вирус гриппа А/h2N1 стал возбудителем эпидемии гриппа в России. Современные вирусы гриппа А/h2N1 обладают низкой иммуногенной активностью, свежие выделенные изоляты вируса взаимодействуют только в эритроцитами млекопитающих (человека 0 группы и морских свинок).
Рис. 2. Возникновение новых штаммов вируса гриппа в человеческой популяции и связанные с ними пандемии
В прошлом столетии вирусы гриппа типа А претерпели значительные генетические изменения, результатом чего явились глобальные пандемии с высокой летальностью среди людей. Самая большая пандемия гриппа (h2N1) была в 1918-1919 гг. («испанка»). Вирус, появившийся в 1918 г проделал выраженный дрейф, исходные (Hsw1N1) и конечные (h2N1) его варианты считаются шифтовыми. Вирус вызвал опустошительную эпидемия, унесшую 20 млн жизней (половина погибших — молодые люди в возрасте от 20 до 50 лет (M.T. Osterholm, 2005).
Исследования J.K. Tanbenberger et al., (2005) показали, что вирус, вызвавший пандемию 1918 г., не являлся реассортантом между птичьим вирусом гриппа и вирусом гриппа человека — все 8 генов вируса h2N1 имели больше сходство с вариантами «птичьего» вируса, нежели человеческого (рис. 3). Поэтому, по мнению R.B. Belshe (2005) вирус гриппа птиц, должен инфицировать (минуя промежуточного хозяина) человека, передаваясь от человека к человеку.
Рис. 3. Механизмы происхождения пандемических вирусов гриппа
- «Азиатский» грипп (1957-1958 гг.), вызванный вирусом А/H2N2, который впервые зарегистрирован в Центральном Китае, не отличался столь драматичностью для человечества, но общая летальность в мире составила 1 -2 млн чел. Причем самая высокая смертность наблюдалась среди больных старше 65 лет. Пандемии 1957 и 1968 гг. были вызваны новыми вирусами, появившимися в результате реассортации. В 1957 г двойное инфицирование, вероятно, человека или свиньи птичьим вирусом H2N2 и человеческим вирусом h2N1 дало начало новому вирусу, содержащему гены НА, NА и ген, кодирующий один из белков полимеразы (РВ1) — от «птичьего» вируса и 5 генетических сегментов вируса гриппа h2N1 человека 1918 г. Этот вирус циркулировал в популяции человека до 1968 г, когда его вытеснил новый реассортантный вирус H3N2 (Гонконг).
- «Гонконгский» грипп, вызванный вирусом А/H3N2 (1968-1969 гг.) впервые был выделен в Гонконге. Он появился в результате замены Н2 и полимеразного гена (РВ1) вируса H2N2 на 2 новых гена вируса гриппа птиц Н3 и РВ1. Остальные 6 генов этого вируса были человеческими (т.е. от предыдущего вируса 1957 г) и сегодня потомок этого вируса, согласно рис. 3, продолжает циркулировать среди людей. Гены вируса А /H3N2, происходят от вируса, вызвавшего пандемию в 1918 г (R.B. Belshe, 2005) (рис.3). Гонконгский грипп не отличался столь высокой смертностью, как в предыдущие пандемии, так как антигенные изменения произошли только в НА (антигенный шифт), а NА вируса осталась неизмененной. Наличие антител к NА, не предотвращает развития заболевания, однако может ослабить тяжесть течения инфекции (W.P. Glesen, 1996). Вполне вероятно, что низкая смертность, среди пожилых людей, связана с штаммом вируса гриппа с Н3, который циркулировал в мире в этом столетии и поэтому люди старше 60 лет имели протективные антитела к этому вирусу (L. Simonsen et al., 2004).
- После 20-летнего перерыва стал снова циркулировать новый вариант вируса гриппа А/h2N1, который в 1977-1978 гг. вызвал эпидемию, достаточно умеренную, после которой в мире одновременно начали циркулировать 3 варианта возбудителя: вирусы гриппа А подтипов h2N1 и H3N2 и типа В.
Важно отметить, что вирусы гриппа птиц «участвуют» в появлении новых «человеческих» вирусов гриппа, которые характеризуются высокой патогенностью и способностью вызывать пандемии (Э.Г. Деева, 2008). Эти вирусы (h2N1, H2N2 и H3N2) имели различный набор внутренних генов, происхождение которых указывает на их филогенетическую связь с вирусами птиц и свиней.
Каковы же механизмы происхождения пандемических штаммов и какие биологические характеристики необходимы для появления высокопатогенного вируса с пандемическим потенциалом?
Для вирусов гриппа А характерна высокая частота возникновения реассортантов в результате смешанного заражения, что обусловлено сегментированностью вирусного генома. Преобладание реассортанта определенного генного состава считается результатом селекции, при которой из обширного набора разных реассортантов отбирается именно такой, который наиболее приспособлен к репродукции в данных условиях (Н.Л. Варич с соавт., 2009). Штаммоспецифические свойства геномных сегментов могут оказать сильное влияние на генный состав реассортантов в неселективных условиях. Другими словами, отличительной особенностью вирусов гриппа является то, что в восьми из генных сегментов, особенно в гене НА, происходят частые и непредсказуемые мутации. Реассортация играет важную роль в появлении новых вариантов вирусов, в частности в происхождении пандемических штаммов. И иногда нельзя исключить возможность появления на протяжении пандемии вируса с более высокой вирулентностью.
Современные исследования показали, что генная структура нового вируса А/h2N1 является сложной и в его состав, как мы уже отмечали во введении, входят гены свиного гриппа, поражающего свиней Северной Америки; гены свиного гриппа, поражающего свиней Европы и Азии; гены птичьего гриппа; гены человеческого гриппа. По сути, гены нового вируса получены из четырех различных источников. Микрофотография вируса гриппа А/h2N1 представлена на рис. 4.
Рис. 4. Микрофотография вируса гриппа А/h2N1
ВОЗ опубликовала «Руководство для лабораторий гриппа» и представила новые данные по последовательности вирусных генов и их длины реассортантного нового вируса гриппа А/h2N1 (изолят — А/California/04/2009): НА, NА, М, РВ1, РВ2, РА, NР, NS. Эти данные свидетельствуют о формировании нового пандемического варианта вируса, создавая всеобщую уязвимость перед инфекцией в виду отсутствия к иммунитета. Становится понятным, что пандемические варианты вируса гриппа возникают посредством как минимум двух механизмов:
- реассортации между вирусами гриппа животных/птиц и человека;
- непосредственной адаптации вируса животных/птиц к человеку.
Для понимания происхождения пандемических вирусов гриппа важное значение имеет изучение свойств природного резервуара инфекции и путях эволюции этого семейства вирусов при смене хозяина. Уже хорошо известно и это можно утверждать, что водоплавающие птицы являются природным резервуаром вирусов гриппа А (адаптированные к этим промежуточным хозяевам в течение многих столетий), о чем свидетельствует носительство всех 16 подтипов НА этого вируса. Через фекалии птиц, которые в воде могут сохраняться более 400 дней (Грипп птиц…, 2005), вирусы могут передаваться другим видам животных при употреблении воды из водоема. (K.G. Nicholson et al., 2003). Это подтверждается филогенетическим анализом последовательностей нуклеиновых кислот разных подтипов вирусов гриппа А от различных хозяев и из различных географических регионов.
Анализ последовательностей гена нуклеопротеина показал, что вирусы гриппа птиц эволюционировали с появлением 5 специфических хозяйских линий: вирусы диких и домашних лошадей, чаек, свиней и человека. Причем (!) вирусы гриппа человека и свиней составляют так называемую сестринскую группу, что свидетельствует об их близком родстве и, естественно, общем происхождении. Предшественник вирусов гриппа человека и классический свиной вирус, по-видимому, имели полностью «птичье» происхождение. В странах Средней Азии, по известным причинам, свинина не популярна, и эти животные практически отсутствуют в животноводстве. Это приводит к тому, что (в отличие от Китая, например), данный регион не имеет в популяции домашних животных основного промежуточного хозяина — свиней, поэтому вероятность «зарождения» пандемических вирусов в Среднеазиатском регионе ниже, чем в Китае, что практически и следует из данных по анализу их происхождения (Грипп птиц, 2005). Постоянный источник генов пандемических вирусов гриппа, существует ( в фенотипически неизменнном состоянии), в природном резервуаре вирусов водоплавающих и перелетных птиц (R.G. Welster, 1998). Следует иметь в виду, что предшественники вирусов, вызвавших пандемию «испанки» (1918 г), как и вирусы, явившиеся источником генома пандемических штаммов Азия/57 и Гонконг/68, до сих пор циркулируют среди популяции диких птиц с незначительными мутационными изменениями (Грипп птиц…, 2005).
Читать дальше: Эпидемиология гриппа, вызванного вирусом А/h2N1
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
- Renouard, «Histoire de la medicine» (П., 1948).
- Moustafine R. I., Bobyleva V. L., Bukhovets A. V., Garipova V. R.,Kabanova T. V., Kemenova V. A., Van den Mooter G. Structural transformations during swelling of polycomplex matrices based on countercharged (meth)acrylate copolymers (Eudragit® EPO/Eudragit® L 100-55). Journal of Pharmaceutical Sciences. 2011; 100:874–885. DOI:10.1002/jps.22320.
- Wunderlich, «Geschichte der Medicin» (Штуттгардт, 1958).
- https://pcr.news/novosti/rnk-polimeraza-virusa-grippa-novoe-uyazvimoe-mesto/.
- https://aptstore.ru/articles/kak-opredelit-tip-virusa-grippa/.
- https://helix.ru/kb/item/09-120.
- https://medi.ru/info/10237/.
- Sprengel, «Pragmatische Geschichte der Heilkunde».
- Ковнер, «Очерки истории M.».
- Pund A. U., Shandge R. S., Pote A. K. Current approaches on gastroretentive drug delivery systems. Journal of Drug Delivery and Therapeutics. 2020; 10(1): 139–146. DOI: 10.22270/jddt.v10i1.3803.