[09-171] Типирование Influenza virus A (h2N1, H3N2)
2085 руб.
Типирование Influenza virus A (h2N1, H3N2) — идентификация субтипов вируса гриппа типа А путем качественного выявления в исследуемом материале вирусной нуклеиновой кислоты (РНК).
Синонимы русские
Идентификация субтипов h2N1 и H3N2 вируса гриппа А методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР).
Синонимы английские
Influenza virus A RT-PCR subtyping, Influenza virus reverse transcription PCR test.
Метод исследования
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Мазок из зева (ротоглотки) и носа, мокрота.
Общая информация об исследовании
Вирус гриппа относится к РНКсодержащим вирусам. Род вирусов гриппа включает три типа вирусов: А, В и С. Вирусная частица имеет сферическую форму, в центре которой находится генетический материал вируса — РНК, а в оболочке присутствуют сложные белки — гемагглютинин (Н) и нейраминидаза (N). Для вирусов гриппа типа А характерна постоянная изменчивость этих поверхностных белков: на данный момент известно 15 вариантов гемагглютинина и 9 вариантов нейраминидазы. Их сочетание в определенной комбинации определяет субтип вируса. Вирусы субтипов h2N1 и H3N2 вызывают сезонный грипп человека.
Попадая в организм человека, вирус гриппа проникает в клетки эпителия слизистой оболочки дыхательных путей и размножается в них. Пораженные вирусом клетки дегенерируют, погибают и отторгаются. Таким образом, в отделяемом дыхательных путей (слизь, мокрота и т.п.) присутствуют погибшие эпителиальные клетки вместе с вирусными частицами.
Идентификация субтипа вируса проводится методом полимеразной цепной реакции. Принцип метода основан на обнаружении в материале специфичных фрагментов вирусной РНК, их избирательном синтезе с образованием огромного числа копий, что позволяет их легко детектировать, в том числе визуально. К преимуществам метода ПЦР можно отнести:
прямое определение наличия возбудителя — выявление специфического участка РНК возбудителя дает прямое указание на присутствие вируса;
высокую специфичность — в исследуемом материале идентифицируется уникальный, характерный только для данного вируса фрагмент РНК;
высокую чувствительность — ПЦР позволяет обнаружить возбудитель, даже если его исходная концентрация в исследуемом материале чрезвычайно мала.
Однако стоит отметить, что обнаружение вирусной РНК методом ПЦР не обязательно указывает на обнаружение жизнеспособного вируса или продолжающееся его размножение.
Для чего используется исследование?
- Для идентификации субтипа вируса гриппа.
Когда назначается исследование?
При нетипичных проявлениях заболевания;
при высоком риске осложнений от гриппа (возраст более 65 и менее 2 лет, беременные, а также женщины в период первых двух недель после родов, лица с хроническими заболеваниями легких, сердца, почек, пациенты с иммунодефицитом или гематологическими заболеваниями);
при идентификации возбудителя у пациентов, заболевших вне эпидемиологического сезона.
Что означают результаты?
Референсные значения: не обнаружено.
Положительный результат — если искомый фрагмент вирусной РНК обнаружен — инфицирование вирусом гриппа А определенного субтипа.
Отрицательный результат — если искомый фрагмент вирусной РНК не обнаружен — отсутствие инфекции.
Что может влиять на результат?
Количество дней, прошедшее от начала болезни (после 4 дней возрастает вероятность необнаружения вируса).
Исследуемый образец — при инфекции нижних дыхательных путей вирус может не выявляться в образце, полученном из верхних дыхательных путей (мазки из носа, ротоглотки). В таких случаях необходимо повторить анализ с исследованием отделяемого нижних дыхательных путей.
Важные замечания
- У иммунокомпетентных лиц с неосложненным гриппом вирусовыделение в верхних дыхательных путях, как правило, значительно уменьшается после 4 дней болезни, соответственно, снижается вероятность выделения возбудителя. Поэтому образцы для исследования у таких пациентов должны быть получены в первые четыре дня заболевания, когда выделение вируса максимально. И напротив, у пациентов с ослабленным иммунитетом и при инфекции нижних дыхательных путей (вирусная пневмония) выделение вируса в бронхиальный секрет сохраняется дольше.
- Ожидание результата исследования или отрицательный результат при очевидной клинической картине не должны быть препятствием для назначения противовирусной терапии.
Также рекомендуется
Общий анализ крови с лейкоцитарной формулой
С-реактивный белок
Influenza virus A/h2, РНК [реал-тайм ПЦР]
Mycoplasma pneumoniae, ДНК [ПЦР]
Adenovirus, ДНК [реал-тайм ПЦР]
Streptococcus pneumoniae, ДНК [реал-тайм ПЦР]
Кто назначает исследование?
Инфекционист, терапевт, врач общей практики, педиатр, эпидемиолог.
Литература
Инфекционные болезни: национальное руководство / Под ред. Н. Д. Ющука, Ю. Я. Венгерова. — М.: ГЭОТАР-Медиа, 2009. С. 701-710.
Клиническая лабораторная диагностика: национальное руководство: в 2 т. — T. II / Под ред. В. В. Долгова, В. В. Меньшикова. — М.: ГЭОТАР-Медиа, 2012. С. 649-653.
Guidance for Clinicians on the Use of RT-PCR and Other Molecular Assays for Diagnosis of Influenza Virus Infection by Centers of Disease Control and Prevention, U.S. Department of Health and Human Services, 2016.
Henry’s Clinical Diagnosis and Management by Laboratory Methods, 23e by Richard A. McPherson MD MSc (), Matthew R. Pincus MD PhD (). St. Louis, Missouri : Elsevier, 2016. Page 1316.
Ионный щит вируса гриппа
Пожалуй, невозможно найти человека, который хотя бы один раз в жизни не болел гриппом. Большинство же из нас поневоле «общается» с этим инфекционным агентом многократно. Об этом свидетельствует и огромное число лекарств, призванных облегчить безобидный только на первый взгляд недуг. Увы, грипп относится к тому ряду болезней, о которых говорят, что ими болеют без лечения 7 дней, с лечением — неделю. Что же обеспечивает вирусам гриппа такую феноменальную стойкость к лекарственным средствам и атакам нашей иммунной системы? Ответ на этот вопрос, возможно, лежит в прямом смысле на поверхности — на поверхности самого гриппозного вириона…
Геном вируса гриппа, как известно, способен мутировать исключительно высокими темпами благодаря случайным «ошибкам» при тиражировании своей наследственной информации. Частота нуклеотидных замен в его наследственном материале в сотни тысяч раз выше, чем в геноме человека.
Именно эта особенность вируса лежит в основе эффективного механизма, защищающего его от иммунной системы человека, поскольку приводит к появлению таких штаммов, с которыми не могут связываться антитела, ранее наработанные в организме в ответ на инфекцию или вакцинацию. Мутантный штамм поэтому активно размножается до тех пор, пока в организме не будут выработаны новые специфичные антитела.
Молекулярные механизмы, обеспечивающие проникновение вируса внутрь клетки-мишени, до сих пор остаются предметом многих научных исследований. Главная цель последних — помочь в разработке лекарственных препаратов, способных предотвратить инфицирование клетки вирусом. Остановить болезнь на начальной стадии крайне важно — это означает не дать вирусной частице создать армию своих клонов, готовых к заражению других здоровых клеток.
В настоящее время в связи с возможностью новой пандемии гриппа, причиной которой может стать мутированный штамм так называемого птичьего гриппа, исследования вируса гриппа типа А (к нему относится большинство штаммов гриппа млекопитающих и птиц) приобрели еще большую актуальность. Создание новых эффективных средств профилактики и лечения этого заболевания требует глубокого понимания сложных механизмов межмолекулярных взаимодействий, процессов регуляции работы генов как вируса, так и организма хозяина.
Не только для широкого круга читателей, но и для многих специалистов необычным и малоизвестным подходом в этой области являются методы компьютерного моделирования, позволяющие реконструировать закономерности молекулярной эволюции и проводить своего рода виртуальные «эксперименты» как с отдельно взятыми молекулами, так и с молекулярно-генетическими системами. Благодаря этим методам можно выявить перспективные молекулярные мишени для создания лекарственных препаратов нового поколения против различных вирусных и бактериальных инфекций.
В лаборатории теоретической генетики ИЦиГ СО РАН компьютерные методы и подходы в эволюционной биологии и протеомики (науки о белках) активно развиваются в течение последних 15 лет. Одним из важнейших объектов исследований в настоящее время стал вирус гриппа А, точнее — гемагглютинин, один из его поверхностных белков.
Гемагглютинин — «абордажный крюк» вируса
Прежде чем перейти непосредственно к результатам компьютерного моделирования, необходимо ближе познакомиться со строением и «образом жизни» гриппозного вириона, особенно с его структурно-функциональными белковыми структурами.
Генетический материал вируса защищен оболочкой из особого белка, вокруг которой располагается мембрана из липидов (жироподобных веществ). В ней удерживаются молекулы трех белков: гемагглютинина, нейраминидазы и белка М 2, формирующего особые ионные каналы. При помощи гемагглютинина вирус прикрепляется к клеточной мембране, а нейраминидаза ее разрушает, открывая вирусу путь внутрь клетки. Затем внутри вириона-захватчика благодаря ионным каналам изменяется кислотность среды (pH), чем создаются условия для освобождения генетического материала из вирусной капсулы.
Таким образом, гемагглютинин играет одну из важнейших ролей при инфицировании вирусом клетки-мишени. На поверхности вирусной оболочки он присутствует в виде тримеров, т. е. комплексов из трех молекул. Каждая молекула, в свою очередь, состоит из двух субъединиц: одна обеспечивает первичный контакт с клеткой, вторая отвечает за слияние с клеточной мембраной. Процесс слияния также далеко не прост и сопровождается значительными перестройками самой молекулы гемагглютинина, в результате которых из внутренней части глобулы белка высвобождается «спрятанный» там особый пептид слияния.
Для инфицированного организма поверхностные белки вируса, включая гемагглютинин, представляют объект, требующий пристального внимания, поскольку являются антигенами — веществами, по которым иммунная система распознает инфекционного интервента. В вирусных белках можно выделить так называемые антигенные детерминанты — участки, с которыми предпочтительно связываются антитела, специфические защитные белки иммунной системы. Мутации, вызывающие структурные изменения в подобных местах, т. е. меняющие форму и расположение антигенных детерминант, как раз и приводят к образованию новых вирусных штаммов. Такие вирусы становятся практически «невидимыми» для антител, уже циркулирующих в крови зараженного организма, что делает его безоружным перед нашествием.
Мы предположили, что в ряду мутаций, защищающих вирусные белки от действия антител, помимо структурных могут существовать и другие. Речь идет о том, что в местах антигенных детерминант в результате мутаций появляются участки, с которыми могут связываться лиганды — молекулы или ионы, способные образовывать с белком комплексные соединения. В результате антитела инфицированного организма не могут взаимодействовать с подобными хорошо «защищенным» вирусными антигенами. Проверка этой гипотезы была осуществлена с применением разработанных в нашей лаборатории компьютерных методов молекулярного моделирования.
Что увидел компьютер
В принципе белковые молекулы могут взаимодействовать с другими молекулами самой разной природы: с макромолекулами, в числе которых могут быть белки или нуклеиновые кислоты, носители генетической информации; с низкомолекулярными соединениями; а также с различными ионами. И в этом смысле белки вирусов ничем не отличаются от белков других живых организмов, в том числе человека.
Подобные универсальные взаимодействия лежат в основе метаболических путей, транспортных молекулярных потоков, путей передачи сигналов… На поверхности белков находятся специальные места «посадки» молекул-лигандов — функциональные сайты, — которые своей уникальной структурой и обеспечивают специфическое связывание с этими молекулами.
А теперь давайте вернемся к нашему «герою» — гемагглютинину — и посмотрим результаты компьютерного анализа. Прежде всего отметим, что поверхность гемагглютинина в отличие от других белков в высокой степени обогащена местами посадки различных ионов. Более того — на ней присутствует большое число потенциальных мест такой посадки, которые могут превратиться в «действующие» сайты связывания уже в результате одиночной мутации, т. е. замены всего лишь одной пары нуклеотидов!
Возможно, именно эти свойства гемагглютинина позволяют вирусу гриппа с легкостью ускользать от нашей иммунной системы, обеспечивая его высокую эпидемичность. Аргументом в пользу этого соображения является тот факт, что выявленные участки связывания ионов практически перекрываются с участками расположения антигенных детерминант.
В лаборатории теоретической генетики ИЦиГ СО РАН создана база данных (PDBSite), содержащая информацию о пространственных структурах более чем 30 тыс. различных функциональных участков (сайтов) белков, включая каталитические центры ферментов, сайты взаимодействий белок-белок, белок-ДНК/РНК, белок-лекарственные препараты и т. д. В базе в удобном для поиска и использования виде хранятся данные о физико-химических, структурных и эволюционных характеристиках этих сайтов, полученные с помощью компьютерного анализа экспериментально расшифрованных комплексов. Эти сведения успешно используются для распознавания функциональных сайтов в пространственных структурах малоизученных белков путем определения их структурного сходства с известными. Например, в результате анализа структуры гемагглютинина — поверхностного белка вируса гриппа — выяснилось, что один из его участков схож с сайтом связывания сульфат-иона (SO4), что свидетельствует о потенциальной способности этого белка связываться в этом участке с сульфат-ионом
Как известно, антитела, выработанные в результате иммунного ответа на инфекцию, связываются с антигенными детерминантами, что приводит к нейтрализации вирусных частиц и их дальнейшему разрушению под действием иммунной системы. Очевидно, что связывание иона с антигенной детерминантой будет препятствовать образованию устойчивого комплекса антиген-антитело, в результате чего вирус будет «щитом» отгорожен от воздействия иммунной системы.
Подтверждением нашей гипотезы «ионного щита» вируса гриппа стала еще одна особенность, которую удалось обнаружить у гемагглютинина: предполагаемые сайты связывания ионов на его молекуле совпадают с уже известными участками, отвечающими за адаптивную молекулярную эволюцию этого белка.
Адаптивными обычно считаются такие мутации, которые повышают приспособленность несущего их организма. И действительно, мутации, повреждающие антигенные детерминанты, являются для вируса гриппа адаптивными. Одним из основных механизмов адаптивной эволюции поверхностного белка вируса гриппа, очевидно, как раз и является возникновение сайтов связывания ионов в этих важнейших для воспроизводства и выживания вируса участках. Результаты исследования недвусмысленно свидетельствуют, что новое поколение вакцин для нейтрализации вируса гриппа должно конструироваться с учетом возможного связывания ионов с поверхностным вирусным белком — крайне простого и эффективного механизма защиты вируса, основанного на результатах одиночных мутационных событий. Нельзя не учитывать и другие возможные последствия формирования «ионного щита»: например, заряженные частицы на поверхности вируса могут облегчать его слияние с клеточной мембраной и проникновение в клетку.
В пространственной структуре поверхностного белка вируса гриппа обнаружено множество сайтов связывания различных ионов (а также потенциальных мест такой посадки), благодаря чему вокруг вируса может формироваться своеобразный ионный щит, защищающий его от атак иммунной системы
Высказанные нами предположения, позволившие сформировать новый взгляд на проблему механизмов защиты вирусов от атаки иммунной системы организма-хозяина, а также обнаружить новых молекулярных участников, задействованных в процессе проникновения вируса внутрь клетки, безусловно, требуют дальнейшего анализа и экспериментальной проверки.
Однако то, что ионы могут быть важными факторами, регулирующими жизненный цикл вируса гриппа, уже не вызывает сомнения. Как и то, что исследования подобных молекулярных механизмов будут содействовать открытию новых фармакологических мишеней и созданию эффективных вакцин и лекарственных препаратов.
Поверхностные белки вируса гриппа А: как оставаться на плаву в океане эволюции
Возможность предсказывать эволюционную динамику вируса гриппа A чрезвычайно важна для здравоохранения: разработанная в соответствии с предсказаниями вакцина, применяющаяся во время сезонных вспышек заболевания, должна обеспечивать эффективную защиту от этой тяжелой инфекции, чреватой серьезными осложнениями. Аминокислотные замены в двух ключевых белках вируса гриппа A, взаимодействующих с иммунной системой, — нейраминидазе и гемагглютинине — происходят довольно часто и помогают вирусу избегать противодействия иммунной системы хозяина. Ученые из Сколковского института науки и технологий и других российских научно-исследовательских институтов показали, что для частоты таких аминокислотных замен характерна любопытная особенность: чем больше времени прошло с момента возникновения очередного варианта участка белка с антигенными свойствами, тем больше вероятность, что он будет заменен другим вариантом. Результаты этого биоинформатического анализа недавно были опубликованы в журнале PNAS.
Новые мутации постоянно возникают и в клетках, и в вирусных геномах в силу разных причин: ошибок ферментов, ответственных за репликацию и репарацию, мутагенных факторов окружающей среды и других. При воспроизведении вирусных частиц и делении клеток появляются новые варианты генов, приводящие к аминокислотным заменам в соответствующих белках. Чем сильнее повышает относительную приспособленность организма некая аминокислота в определенном белке, тем ниже вероятность того, что впоследствии она будет заменена на другую аминокислоту. Верно и обратное: «неудачные» замены быстро исчезают, и вероятность повторных замен в этом случае больше. Казалось бы, эти утверждения, лежащие в основе эволюционной биологии, очень просты и логичны. Однако когда дело доходит до попыток предсказания наиболее вероятных мутаций, исследователи сталкиваются с массой сложностей. Особенно важны подобные предсказания в изучении эволюционной динамики патогенов, в частности, вируса гриппа A , сезонные вспышки которого прекрасно знакомы жителям мегаполисов. Ошибки в предсказаниях приводят к тому, что заранее созданная вакцина оказывается малоэффективной или вовсе неэффективной против вируса, циркулирующего в конкретный год.
Вирус гриппа A очень изменчив и постоянно подстраивается под иммунную систему хозяина с помощью аминокислотных замен в двух поверхностных белках, обладающих свойствами антигенов, — гемагглютинине (HA) и нейраминидазе (NA). Эти два белка уже стали классическими примерами, иллюстрирующими адаптивную эволюцию (рис. 1-3). Названия штаммов вируса гриппа также происходят от вариантов этих белков: так, название h2N1 означает, что вирусные частицы содержат гемагглютинин первого типа и нейраминидазу первого типа.
Рисунок 1. Общий вид вириона вируса гриппа A в разрезе
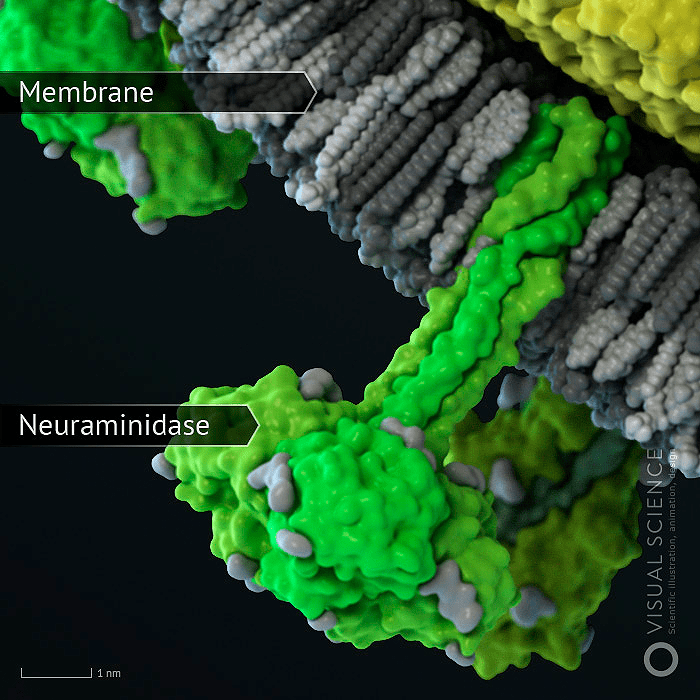
Рисунок 2. Молекула нейраминидазы, заякоренная в мембране вириона
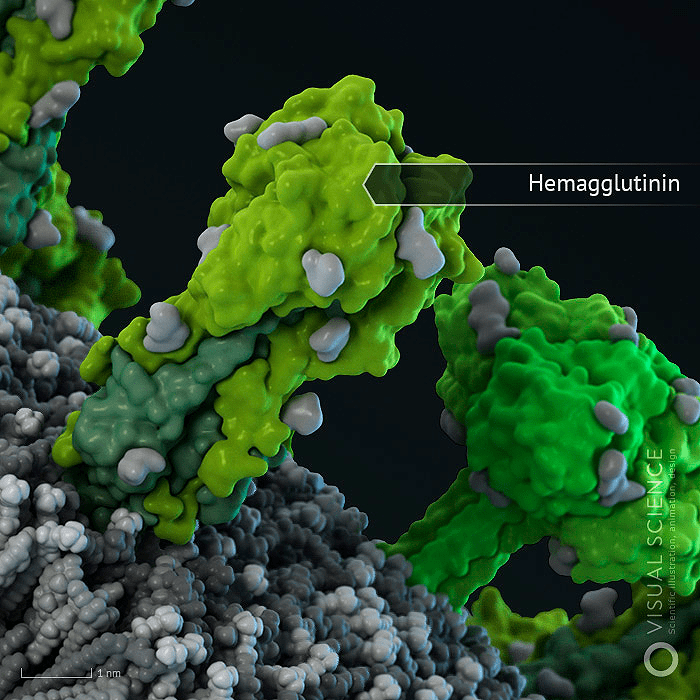
Рисунок 3. Молекула гемаглютинина в мембране вириона
В гемагглютинине и нейраминидазе постоянно происходят несинонимичные аминокислотные замены, которые подхватываются или отбраковываются отбором. Но от чего зависит скорость эволюционирования определенных аминокислотных позиций? Как сообщается в недавней статье российских ученых, вышедшей в PNAS, важным фактором является время возникновения новой аллели (варианта гена): чем больший срок прошел с момента ее возникновения, тем выше вероятность появления в ней новых мутаций [1].
Ученые рассматривали два штамма вируса гриппа A: h2N1, вызывающий сезонные вспышки, и H3N2. Оказалось, что при возникновении аминокислотных замен в антигенах у обоих штаммов проявляется тенденция к замене тех вариантов, которые появились наиболее давно. Однако те участки вирусных белков, которые находятся внутри вирусной частицы и не контактируют с иммунной системой, демонстрируют строго обратную закономерность: наиболее «старые» аллели мутируют реже недавних.
Исследователи восстанавливали последовательность аминокислотных замен, происходивших в ходе эволюции штаммов h2N1 и H3N2 вируса гриппа. Чтобы оценить, насколько скорость аминокислотных замен в определенном варианте белка зависит от времени его возникновения, ученые разработали специальный статистический тест, эффективность и чувствительность которого была предварительно показана на серии искусственно созданных «нулевых» моделей, имитирующих аминокислотные последовательности белков вируса.
Как показал биоинформатический анализ, в случае H3N2 варианты и нейроаминидазы, и гемагглютинина заменялись другими тем чаще, чем больше времени прошло с момента их возникновения. С h2N1, чьи поверхностные антигены изменяются не столь быстро, ситуация оказалась сложнее: выявить четкий тренд к повышению вероятности замены «старых» аллелей в его случае не удалось.
Исследователи показали, что скорость замен в разных частях белка может быть различной в зависимости от выполняемых функций. Мутации, определяющие специфичность или активность белка, закрепляются наиболее эффективно: так, самым прочно закрепленным вариантом в белке h2 оказался остаток серина 151, который отвечает за связывание h2 с рецептором. Этот вариант имеется у большинства изолятов штамма h2N1, возникших после 1976 года. Завидную стабильность демонстрируют и те участки белковых молекул, которые обращены внутрь вирусных частиц. Вместе с тем самые изменчивые участки, как правило, обеспечивают антигенные свойства вируса и отвечают за взаимодействие с компонентами иммунной системы. Оно и понятно: вирусу постоянно приходится «изобретать» новые варианты, чтобы уворачиваться от иммунитета и не распознаваться имеющимися в его арсенале антителами.
Стоит, однако, отметить, что предложенный авторами статьи подход имеет ряд ограничений. В частности, для правильных оценок времени возникновения варианта белка необходимо иметь достоверное филогенетическое дерево и восстановленный предковый вариант белка, что можно получить далеко не всегда. Тем не менее можно надеяться, что разработанный подход поможет улучшить наше понимание эволюционной динамики патогенов и принимать соответствующие меры по предотвращению вспышек и эпидемий, улучшая качество предсказаний при разработке вакцин.
- Anfisa V. Popova, Ksenia R. Safina, Vasily V. Ptushenko, Anastasia V. Stolyarova, Alexander V. Favorov, et. al.. (2019). Allele-specific nonionarity in evolution of influenza A virus surface proteins. Proc Natl Acad Sci USA. 116, 21104-21112;
- Много — не значит хорошо: «Ультрикс», «Гриппол», «Совигрипп» — что выбрать?.
- Ковнер, «Очерки истории M.».
- Moustafine R. I., Bobyleva V. L., Bukhovets A. V., Garipova V. R.,Kabanova T. V., Kemenova V. A., Van den Mooter G. Structural transformations during swelling of polycomplex matrices based on countercharged (meth)acrylate copolymers (Eudragit® EPO/Eudragit® L 100-55). Journal of Pharmaceutical Sciences. 2011; 100:874–885. DOI:10.1002/jps.22320.
- Haeser, «Handbuch der Gesch. d. Medicin».
- https://helix.ru/kb/item/09-171.
- https://scfh.ru/papers/ionnyy-shchit-virusa-grippa/.
- https://biomolecula.ru/articles/poverkhnostnye-belki-virusa-grippa-a-kak-ostavatsia-na-plavu-v-okeane-evoliutsii.
- Мустафин Р. И., Буховец А. В., Протасова А. А., Шайхрамова Р. Н., Ситенков А. Ю., Семина И. И. Сравнительное исследование поликомплексных систем для гастроретентивной доставки метформина. Разработка и регистрация лекарственных средств. 2015; 1(10): 48–50.