Синонимы, аналоги Статьи
Гриппозная четырехвалентная инактивированная расщепленная
Регистрационный номер:
ЛП-005594
Торговое наименование.
Ультрикс® Квадри
Вакцина гриппозная четырехвалентная инактивированная расщепленная
Международное непатентованное или группировочное наименование.
Вакцина для профилактики гриппа [инактивированная].
Лекарственная форма.
Раствор для внутримышечного введения.
Состав:
1 доза (0,5 мл) содержит:
| Действующие вещества | |
| Антиген вируса гриппа типа A (h2N1) | (15±2,0) мкг ГА; |
| Антиген вируса гриппа типа A (H3N2) | (15±2,0) мкг ГА; |
| Антиген вируса гриппа типа В (линия Yamagata) | (15±2,0) мкг ГА; |
| Антиген вируса гриппа типа В (линия Victoria) | (15±2,0) мкг ГА. |
| Вспомогательные вещества | |
| Полисорбат 80 | не более 250 мкг; |
| Октоксинол-10 | не более 150 мкг; |
| Фосфатно-солевой буферный раствор | до 0,5 мл. |
Примечание: состав фосфатно-солевого буферного раствора: натрия хлорид, динатрия гидрофосфат дигидрат, натрия дигидрофосфат дигидрат, вода для инъекций.
Описание.
Бесцветная или слегка желтоватая прозрачная жидкость, возможно наличие слабой опалесценции.
Характеристика.
Вакцина представляет собой смесь протективных поверхностных и внутренних антигенов вирусов гриппа типа А (подтипы A(h2N1) и A(H3N2)) и типа В (линии Yamagata и линии Victoria) в фосфатно-солевом буферном растворе.
Антигены получают из очищенных вирусов гриппа типа А (подтипы A(h2N1) и A(H3N2)) и типа В (линия Yamagata и линии Victoria), выращенные раздельно в развивающихся куриных эмбрионах.
Антигенный состав вакцины изменяется каждый год в соответствии с эпидемической ситуацией и рекомендациями ВОЗ.
Фармакотерапевтическая группа.
МИБП-вакцина.
Код ATX:
J07BB02.
Иммунологические свойства.
Вакцина формирует высокий специфический иммунитет против гриппа типа А и В. После вакцинации антитела появляются через 8-12 дней, иммунитет сохраняется до 12 месяцев.
Показания к применению.
Активная ежегодная профилактическая иммунизация против сезонного гриппа детей в возрасте от 6 лет, подростков и взрослых до 60 лет.
Вакцина особенно показана:
- Лицам с высоким риском заболевания и возникновения осложнений в случае заболевания гриппом:
— лицам, часто болеющим острыми респираторными вирусными инфекциями;
— лицам, страдающим хроническими соматическими заболеваниями, в том числе болезнями и пороками развития сердечно-сосудистой, дыхательной и центральной нервной систем, хроническими заболеваниями почек, болезнями обмена веществ, сахарным диабетом, хронической анемией, аллергическими заболеваниями (кроме аллергии к куриным белкам), врожденным или приобретенным иммунодефицитом, в том числе инфицированным вирусом иммунодефицита человека.
- Лицам, по роду учебной или профессиональной деятельности имеющим высокий риск заболевания гриппом или заражения им других лиц:
— работникам медицинских и образовательных учреждений, транспорта, коммунальной и социальной сфер, полиции, военнослужащим и т.д.
Противопоказания.
- аллергические реакции на предшествующие прививки гриппозными вакцинами;
- аллергические реакции на куриный белок и другие компоненты вакцины;
- острые лихорадочные, острые инфекционные и неинфекционные заболевания, состояния или обострение хронического заболевания;
- возраст до 18 лет;
При нетяжелых ОРВИ и острых кишечных заболеваниях вакцинацию проводят после нормализации температуры тела вакцинируемого; при хронических заболеваниях в стадии обострения прививки проводят после выздоровления (ремиссии).
С осторожностью.
Не вводить внутривенно!
Перед прививкой вакцинируемые должны быть осмотрены врачом (фельдшером) с обязательным проведением термометрии. При температуре тела выше 37 °С вакцинацию не проводят.
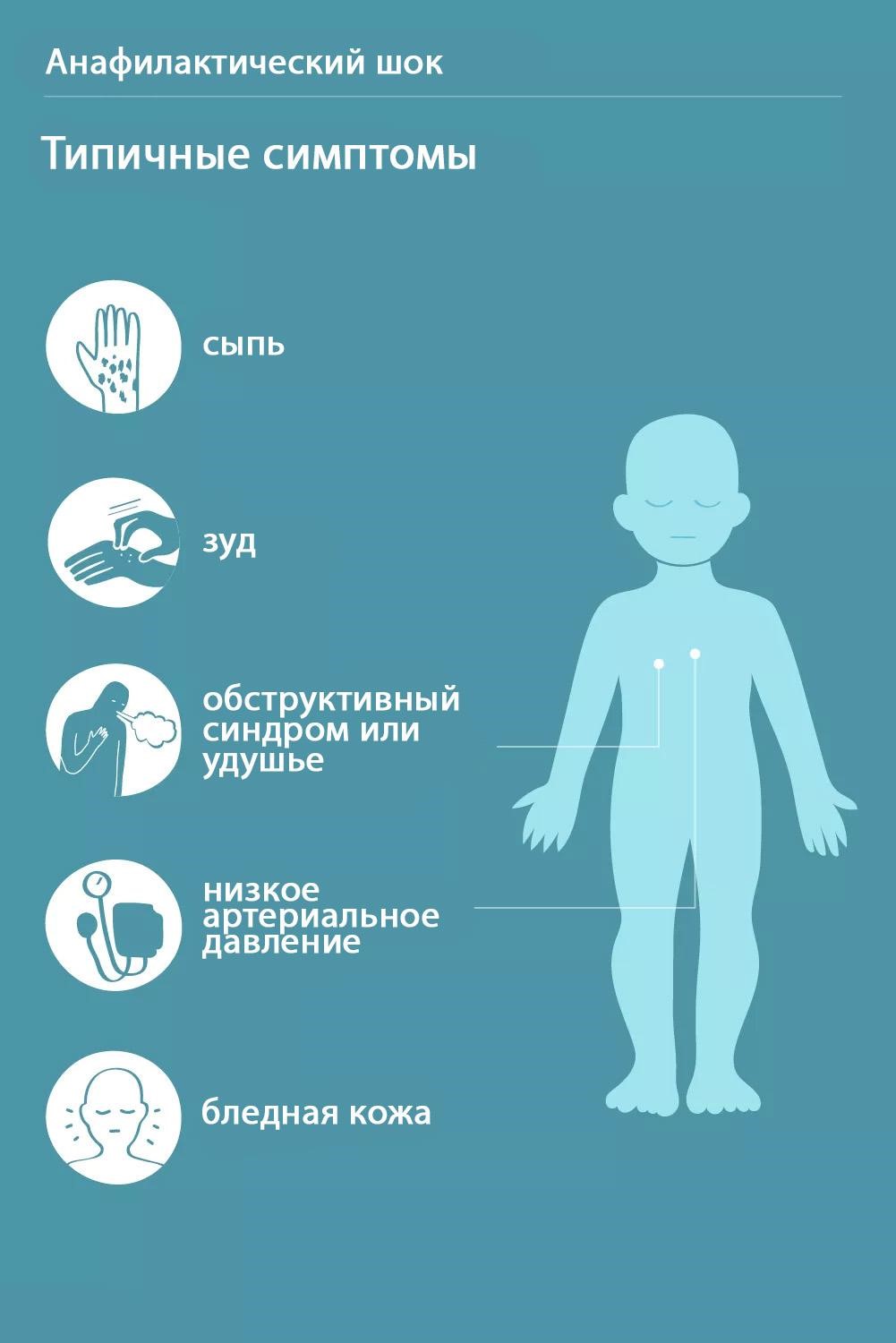
Кабинеты, где проводится вакцинация, должны быть оснащены средствами противошоковой терапии. Вакцинированный должен находиться под наблюдением медработника в течение 30 мин после вакцинации.
Применение при беременности и в период грудного вскармливания.
Опыт применения гриппозных инактивированных вакцин показывает, что вакцинация женщин в период грудного вскармливания не оказывает токсического воздействия на ребенка.
Окончательное решение о вакцинации беременных и кормящих грудью женщин должно приниматься врачом индивидуально с учетом риска заражения гриппом и возможных осложнений, вызванных заболеванием гриппом. Наиболее безопасный период вакцинации беременных женщин — второй и третий триместры беременности.
Способ применения и дозы.
Вакцинация проводится ежегодно в осенне-зимний период. Возможна вакцинация в начале эпидемического подъема заболеваемости гриппом.
Вакцину вводят внутримышечно в дозе 0,5 мл однократно в область дельтовидной мышцы (верхняя треть наружной поверхности плеча).
Не пригоден к применению препарат в шприцах/флаконах с нарушенной целостностью или маркировкой, при изменении физических свойств (цвета, прозрачности), при наличии в растворе посторонних частиц, при истекшем сроке годности, нарушении требований к условиям хранения.
Вскрытие шприцев/флаконов и проведение вакцинации осуществляют при строгом соблюдении правил асептики и антисептики. Препарат во вскрытых шприцах/флаконах хранению не подлежит.
Побочное действие.
Нежелательные явления, представленные ниже, перечислены в соответствии с поражением органов и систем органов и частотой встречаемости. Частота встречаемости определяется следующим образом: очень часто (≥1/10), часто (≥1/100 и <1/10), нечасто (≥1/1000 и <1/100), редко (≥1/10000 и <1/1000), очень редко (< 1/10000, включая отдельные случаи).
Нарушения со стороны нервной системы
Часто: головная боль.
Нарушения со стороны кожи и подкожных тканей
Нечасто: повышенная потливость.
Нарушения со стороны костно-мышечной системы и соединительной ткани
Нечасто: артралгия, миалгия.
Общие расстройства и реакции в месте введения
Часто: боль, гиперемия в месте инъекции.
От «нечасто» до «часто»: уплотнение, отек и зуд в месте инъекции.
Нечасто: повышение температуры, озноб, слабость.
Указанные нежелательные реакции могут развиться в день вакцинации; обычно исчезают самостоятельно через 1-3 дня и не требуют лечения.
Несмотря на отсутствие клинических данных, нельзя исключить возможность развития характерных для гриппозных вакцин неврологических расстройств и аллергических реакций (в том числе реакций немедленного типа на куриный белок и другие компоненты вакцины).
Пациент должен быть проинформирован о необходимости сообщить врачу о любых выраженных или не указанных в данной инструкции побочных реакциях.
Передозировка.
О случаях передозировки не сообщалось.
Взаимодействие с другими лекарственными средствами.
Вакцина может применяться одновременно с инактивированными и живыми вакцинами Национального календаря профилактических прививок (за исключением туберкулезных вакцин) и инактивированными вакцинами Календаря профилактических прививок по эпидемиологическим показаниям (за исключением антирабических). При этом должны учитываться противопоказания к каждой из применяемых вакцин; препараты следует вводить в разные участки тела разными шприцами.
Вакцина может вводиться на фоне базисной терапии основного заболевания. Вакцинация пациентов, получивших иммуносупрессивную терапию (глюкокортикостероиды, цитотоксические препараты, радиотерапия), может быть менее эффективной.
Особые указания.
Использованные и неиспользованные шприцы и флаконы утилизируют в соответствии с требованиями действующего законодательства.
Влияние на способность управлять транспортными средствами, механизмами.
Препарат не влияет на способность управлять транспортом или заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Форма выпуска.
Раствор для внутримышечного введения.
По 0,5 мл (1 доза) в шприцах из стекла с впаянной иглой с защитным колпачком или флаконах стеклянных, герметично укупоренных пробками резиновыми, завальцованных колпачками алюминиевыми или алюмопластиковыми.
По 1 шприцу в контурной ячейковой упаковке, покрытой фольгой алюминиевой или бумагой, в пачке из картона вместе с инструкцией по применению.
По 1 флакону в пачке из картона вместе с инструкцией по применению.
По 10 флаконов в пачке из картона со вставкой из картона вместе с инструкцией по применению.
Условия хранения.
Хранить при температуре от 2 до 8 °С. Не замораживать. Хранить в недоступном для детей месте.
Условия транспортирования.
Транспортировать при температуре от 2 до 8 °С. Не замораживать.
Срок годности.
1 год. Препарат с истекшим сроком годности применению не подлежит.
Условия отпуска.
Отпускают по рецепту (упаковки по 1 шприцу или 1 флакону). Для лечебно-профилактических учреждений (упаковки по 10 флаконов).
Производитель.
ООО «ФОРТ»
Россия, 390540, Рязанская обл., Рязанский район, Окское с/п, 1з.
Владелец регистрационного удостоверения/организация, принимающая претензии потребителя.
ООО «ФОРТ»
Россия, 390540, Рязанская обл., Рязанский район, Окское с/п, 1а.
Рекламации на качество препарата, а также о случаях повышенной реактогенности или развитии осложнений следует направлять в адрес ООО «ФОРТ» с указанием номера серии и даты производства препарата с последующим представлением медицинской документации.
Ультрикс Квадри Вакцина — цена, наличие в аптеках
Указана цена, по которой можно купить Ультрикс Квадри Вакцина в Москве. Точную цену в Вашем городе Вы получите после перехода в службу онлайн заказа лекарств:
planetazdorovo.ru
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
(Ultrix)
Действующее вещество
Вакцина для профилактики гриппа [инактивированная] (Vaccine influenza virus inactivated)
Аналоги по АТХ
J07BB02 Вирус гриппа инактивированный расщепленный или поверхностный антиген
Фармакологическая группа
- МИБП-вакцина [Вакцины, сыворотки, фаги и анатоксины]
Нозологическая классификация (МКБ-10)
список кодов МКБ-10
Состав
| Раствор для внутримышечного введения | 1 доза (0,5 мл) |
| вирусы гриппа, культивированные на куриных эмбрионах, инактивированные, расщепленные, представленные штаммами: | |
| A (h2N1) | (15±2,2) мкг гемагглютинина |
| A (H3N2) | (15±2,2) мкг гемагглютинина |
| B | (15±2,2) мкг гемагглютинина |
| вспомогательное вещество: консервант (мертиолят) — 42,5-57,5 мкг или не содержит консервант | |
| Антигенный состав вакцины изменяется каждый год в соответствии с эпидемической ситуацией и рекомендациями ВОЗ. |
Описание лекарственной формы
Раствор: опалесцирующая бесцветная жидкость.
Характеристика
Вакцина представляет собой смесь высокоочищенных протективных поверхностных и внутренних антигенов вирусов гриппа типа A (h2N1 и H3N2) и типа B.
Фармакологическое действие
Фармакологическое действие — иммуностимулирующее.
Фармакологические (иммунобиологические) свойства
Вакцина формирует высокий специфический иммунитет против гриппа типа А и В, хорошо переносится взрослыми. После вакцинации антитела появляются через 8-12 дней, иммунитет сохраняется до 12 мес. Высокая эффективность вакцины обеспечивается наличием в ней как поверхностных, так и внутренних антигенов вируса гриппа.
Показания препарата Ультрикс®
Профилактика гриппа. Вакцинация рекомендуется следующим группам лиц:
дети с 6 лет;
студенты высших и средних профессиональных учебных заведений;
работающие взрослые, особенно работники медицинских и образовательных учреждений, сферы транспорта, коммунальной сферы;
лица, страдающие хроническими соматическими заболеваниями;
лица, часто болеющие острыми респираторными заболеваниями;
взрослые старше 60 лет.
Противопоказания
аллергические реакции на предшествующие прививки гриппозными вакцинами;
аллергические реакции на куриный белок и компоненты вакцины;
острые лихорадочные состояния или обострение хронического заболевания;
период грудного вскармливания.
Применение при беременности и кормлении грудью
Сведения отсутствуют. Клинические исследования не проводились.
Побочные действия
Введение вакцины может сопровождаться местными и общими реакциями.
Очень редко — в месте введения могут быть реакции в виде болезненности, покраснения и отека кожи.
Крайне редко — у отдельных лиц возможны общие реакции в виде повышенной утомляемости, головной боли, головокружения, субфебрильной температуры, насморка, фарингита, кашля, артралгии, миалгии, тошноты. Указанные реакции обычно исчезают самостоятельно через 1-3 дня.
В исключительно редких случаях — при высокой индивидуальной чувствительности могут наблюдаться аллергические реакции.
Взаимодействие
Вакцина может применяться одновременно с другими инактивированными вакцинами. При этом должны учитываться противопоказания к каждой из применяемых вакцин, препараты должны вводиться в разные участки тела разными шприцами. Вакцинация пациентов, получающих иммуносупрессивную терапию, может быть менее эффективной.
Способ применения и дозы
В/м, в дельтовидную мышцу.
Вакцину вводят однократно в дозе 0,5 мл.
При нетяжелых ОРВИ, острых кишечных заболеваниях вакцинацию проводят после нормализации температуры. Прививки проводят после выздоровления (ремиссия).
В день прививки вакцинируемые должны быть осмотрены врачом/фельдшером с обязательной термометрией. При температуре выше 37 °C вакцинацию не проводят.
Не пригоден к применению препарат в ампулах или шприцах с нарушенной целостностью или маркировкой, при изменении физических свойств (цветность, прозрачность), при истекшем сроке годности, нарушении требований к условиям хранения.
Ампулы
Перед применением вакцину следует выдержать до комнатной температуры и хорошо встряхнуть.
Вскрытие ампул и процедуру вакцинации осуществляют при строгом соблюдении правил асептики и антисептики: перед вскрытием ампульный нож, шейку ампулы протирают ватой, смоченной 70% этиловым спиртом, вскрывают ампулу, набирают вакцину в шприц одноразового применения и удаляют из шприца остаток воздуха. Спиртом протирают кожу в месте инъекции. Препарат во вскрытой ампуле хранению не подлежит.
Шприцы
Следует встряхнуть шприц непосредственно перед инъекцией. Снять защитную крышку с иглы и удалить воздух из шприца, удерживая его в вертикальном положении иглой вверх и медленно нажимая на поршень.
Особые указания
Не вводить в/в.
В кабинетах, где проводится вакцинация, необходимо иметь ЛС для проведения противошоковых мероприятий и купирования анафилактической реакции.
Вакцинированный должен находиться под наблюдением медработника в течение 30 мин после иммунизации.
Влияние на способность управлять транспортными средствами и работать с механизмами. Сведения отсутствуют.
Форма выпуска
Раствор для внутримышечного введения. В ампулах. 10 амп. в пачке из картона или в контурной ячейковой упаковке в пачке из картона с ножом ампульным или скарификатором. При упаковке ампул с пережимом, имеющим кольцо или точку для вскрытия, нож ампульный или скарификатор не вкладывают.
В шприцах инъекционных стерильных однократного применения с иглой инъекционной стерильной однократного применения, с защитным колпачком, 0,5 мл (1 доза) в пачке из картона.
1 шприц инъекционный стерильный однократного применения с иглой инъекционной стерильной однократного применения, с защитным колпачком, в пачке из картона.
На пачке препарата, не содержащего консервант, нанесена предупредительная надпись «Без консерванта».
Производитель
1. ФГУП СПбНИИВС ФМБА России. 198320, Санкт-Петербург, г. Красное Село, ул. Свободы, 52.
2. Филиал ФГУ «48 Центральный научно-исследовательский институт Министерства обороны Российской Федерации» — «Вирусологический центр». 141306, Россия, Московская обл., г. Сергиев Посад-6, ул. Октябрьская, 11.
Владелец регистрационного удостоверения: ООО «ФОРТ». 390000, Россия, Рязанская обл., г. Рязань, ул. Новослободская, 20а.
Тел.: (4912) 70-15-00; факс: (4912) 70-15-01.
Рекламации на качество препарата, а также информацию о случаях повышенной реактогенности или развитии осложнений следует направлять в Федеральную службу по надзору в сфере здравоохранения и социального развития (Росздравнадзор) и в адрес ООО «ФОРТ» с указанием номера серии препарата и даты выпуска с последующим представлением медицинской документации.
Условия отпуска из аптек
По рецепту.
Условия хранения препарата Ультрикс®
При температуре 2-8 °C (не замораживать). В соответствии с СП 3.3.2.1248-03.
Хранить в недоступном для детей месте.
Срок годности препарата Ультрикс®
1 год.
Не применять по истечении срока годности, указанного на упаковке.
(Ultrix)
Ультрикс (Ultrix) — вакцина гриппозная трехвалентная инактивированная расщепленная.
Регистрационное удостоверение: ЛП-005594
Торговое название: Ультрикс
Группировочное название: Вакцина для профилактики гриппа (инактивированная)
Лекарственная форма: Раствор для внутримышечного введения
Страна-производитель: Форт, Россия
Предварительное обследование: не требуется
Стоимость вакцины: 1400 руб.(дополнительно оплачивается осмотр перед вакцинацией)
Применяется: с 6 месяцев
Условия отпуска из аптек: Упаковки по 1 шприцу или 1 флакону — по рецепту врача, Упаковки по 10 флаконов — для лечебно-профилактических учреждений
Наличие вакцины: нет в наличии
Аналоги этой вакцины:
Вакцина «Ультрикс квадри» (Ultrix Quadri ) (с 6 до 60 лет)
Вакцина «Ваксигрипп» (Vaxigrip) (для взрослых и детей c 6 мес.)
Вакцина «Инфлювак» (Influvac) (для взрослых и детей с 6 мес.)
Оставьте заявку на вакцинацию.
Наш менеджер согласует удобное для вас время приема.
Описание вакцины
Состав: 1 доза (0,5 мл) содержит
Действующие вещества:
вирусы гриппа, культивированные на куриных эмбрионах, инактивированные, расщепленные, представленные штаммами, эквивалентными следующим:
- А/Guaпgdопg-Маоnаn/SWL1536/2019 (h2N1)pmd 09-like virus (l5±2,0) мкг ГА;
- A/Hong Kong/2671/2019 (H3N2)-like virus (15±2,0) мкг ГА;
- B/Washington/02/2019 (B/Victoгia lineage)-like virus (15±2,0) мкг ГА.
Вспомогательные вещества:
консервант — мертиолят — (50 ± 7,5) мкг или не содержит консерванта
фосфатно-солевой буферный раствор — до 0,5 мл
Примечание: состав фосфатно-солевого буферного раствора: натрия хлорид, динатрия гидрофосфат дигидрат, натрия дигидрофосфата дигидрат, вода для инъекций.
Описание
Бесцветная или слегка желтоватая прозрачная жидкость, возможно наличие слабой опалесценции.
Характеристика
Вакцина представляет собой смесь высокоочищенных протективных поверхностных и внутренних антигенов вирусов гриппа типа А (h2N1 и НзN2) и типа В в фосфатно-солевом буферном растворе.
Антигенный состав вакцины изменяется каждый год в соответствии с эпидемической ситуацией и рекомендациями ВОЗ для Северного полушария.
Фармакотерапевтическая группа: МИБП- вакцина
Код АТХ: J07ВВ02.
Иммунологические свойства. Вакцина формирует высокий специфический иммунитет против гриппа типов А и В. После вакцинации антитела появляются через 8-12 дней, иммунитет сохраняется до 12 месяцев.
Показания к применению
Активная ежегодная профилактическая иммунизация против сезонного гриппа.
Вакцина без содержания консерванта — дети с месячного возраста, подростки, взрослые без ограничения возраста, женщины на II-III триместрах беременности; вакцина с консервантом — взрослые с 18 лет.
Вакцина особенно показана:
- Лицам, по роду деятельности имеющим высокий риск заболевания гриппом или заражения им других лиц:
- студентам;
- работникам медицинских и образовательных) учреждений, транспорта, коммунальной и социальной сфер, полиции, военнослужащим и т.д.
- учащимся образовательных учреждений.
- Лицам с высоким риском заболевания и возникновения осложнений в случае заболевания гриппом:
- старше 60 лет;
- часто болеющим острыми респираторными вирусными инфекциями;
- страдающим хроническими соматическими заболеваниями, в том числе болезнями и пороками развития сердечно-сосудистой, дыхательной и центральной нервной систем, хроническими заболеваниями почет болезнями обмена веществ, сахарным диабетом, хронической анемией, аллергическими заболеваниями (кроме аллергии к куриным белкам); врожденным или приобретенным иммунодефицитом, в том числе инфицированным вирусом иммунодефицита человека;
- беременным женщинам.
Противопоказания:
- аллергические реакции на предшествующие прививки гриппозными вакцинами;
- аллергические реакции на куриный белок и компоненты вакцины;
- сильная реакция (температура выше 40С, отёк и гиперемия в месте введения свыше 8 см в диаметре) или поствакцинальное осложнение на предыдущее введение вакцин для профилактики гриппа;
- острые инфекционные или неинфекционные заболевания, обострение хронических заболеваний — прививки про водят через 2-4 недели после выздоровления или в период реконвалесценции или ремиссии. При тяжелых ОРВИ, острых кишечных заболеваниях прививки про водят после нормализации температуры;
- период беременности (при применении вакцины с консервантом);
- возраст до 18 лет (при применении вакцины консервантом);
Применение при беременности и в период грудного вскармливания
Данные клинических исследований вакцины с участием женщин на 2 и 3 триместрах беременности показали, что вакцинация не оказывает отрицательного воздействия на плод и организм женщины и может применяться при беременности. Вакцинация данным препаратом может проводиться, начина со 2 триместра беременности.
Опыт применения гриппозных инактивированных вакцин показывает, что вакцинация женщины в период грудного вскармливания не оказывает токсического воздействия на ребенка.
Окончательное решение о вакцинации беременных и кормящих грудью женщин должно приниматься врачом индивидуально С учетом риска заражения гриппом и возможных осложнений, вызванных заболеванием гриппом.
При проведении вакцинации против гриппа беременных женщин используются вакцины, не содержащие консервантов.
Способ применения и дозы
Вакцинация проводится ежегодно в осенне-зимнем период. Возможна вакцинация в начале эпидемического подъема заболеваемости гриппом.
Вакцина вводится только внутримышечно!
Детям от 6 до 11 месяцев вакцину вводят двукратно с интервалом 28 дней в переднебоковую поверхность бедра в дозе 0,25 мл (1/2 дозы).
Детям в возрасте от 12 до 35 месяцев вакцину вводя двукратно с интервалом 28 дней в переднебоковую поверхность бедра или область дельтовидной мышцы в дозе 0,25 мл (1/2 дозы).
Детям старше 36 месяцев, подросткам и взрослым без ограничения возраста вакцину вводят в дозе 0,5 мл в область дельтовидной мышцы.
НЕ ПРИГОДЕН к применению препарат в ампулах, флаконах или шприцах с нарушенной целостностью или маркировкой, при изменении физических свойств (цвета, прозрачности), при наличии в растворе посторонних частиц, при истекшем сроке годности, нарушении требований к условиям хранения.
Правила введения вакцины Ультрикс
1. Ампулы
Перед применением вакцину следует выдержать до комнатной температуры. Ампулу перед вскрытием следует хорошо встряхнуть.
Вскрытие ампул и процедуру вакцинации осуществляют при строгом соблюдении правил асептики и антисептики: перед вскрытием ампульный нож/скарификатор, шейку ампулы протирают ватой , смоченной 70-процентным этиловым спиртом, вскрывают ампулу, набирают вакцину в шприц одноразового применения и удаляют из шприца остаток воздуха. место инъекции протирают 70-процентным спиртом.
Препарат во вскрытой ампуле хранению не подлежит.
2. Флаконы
Перед применением вакцину следует выдержать до комнатной температуры. Флакон перед вскрытием следует хорошо встряхнуть.
Вскрытие флаконов и процедуру вакцинации осуществляют при строгом соблюдении правил асептики и антисептики.
Процедура использования Флакона, содержащего 1 дозу вакцины:
- колпачок флакона обрабатывают 70-процентным этиловым спиртом, используя вату, ватный диск или салфетку;
- флакон вскрывают, удалив с его колпачка пластиковую цветную крышечку или алюминиевый диск. Резиновую пробку флакона не вскрывать!
- пробку флакона обрабатывают 70-процентным спиртом;
- упаковку стерильного шприца одноразового применения вскрывают, при необходимости на канюлю шприца надевают стерильную иглу;
- иглу вводят в резиновую пробку флакона, переворачивают флакон и набирают 0,25 или 0,5 мл вакцины в шприц;
- шприц отсоединяют от иглы, оставляя иглу в пробке флакона;
- на канюлю шприца с набранной одной дозой вакцины надевают новую стерильную иглу, из шприца удаляют остаток воздуха;
- место инъекции протирают 70-процентным спиртом;
- подготовленную вакцину немедленно вводят пациенту.
Для отбора 1/2 дозы (0,25 мл) используют градуированный шприц. При отборе 1 дозы (0,5 мл) извлекают все содержимое флакона.
Остаток вакцины во флаконе должен быть немедленно утилизирован.
Процедура использования Флакона содержащего 5 доз вакцины:
Для введения пациенту вакцины из флакона, содержащего 5 доз, каждый раз должны быть использованы н вые стерильный шприц и стерильная игла.
Поступают как описано выше для флакона, содержащего 1 дозу, за исключением пункта 6)
6. шприц отсоединяют от иглы, оставляя иглу в пробке флакона, флакон накрывают стерильной салфеткой при наборе последующих доз вакцины новую иглу во флакон не вводят. После вскрытия вакцина во флаконе, содержащего 5 доз, должна быть использована в течение не более 2 часов. Вскрытый флакон с вакциной хранят при комнатной температуре под стерильной салфеткой. По истечении двух часов флакон с остатками вакцины утилизируют.
3. Шприцы
Перед применением шприц с вакциной следует подержать до комнатной температуры. Непосредственно перед инъекцией шприц следует хорошо встряхнуть.
Процедура использования шприца без УСТРОЙСТВ предохранительного для предварительно наполненных шприцев:
Защитный колпачок с иглы шприца снимают, осторожно потянув его с иглы без скручивания по направлению от шприца. Из шприца удаляют остаток воздуха.
Место инъекции протирают 70-процентным спиртом. Вакцину немедленно вводят пациенту. Для этого нажимают на поршень, крепко удерживая шприц, и вводят все его содержимое (1 доза).
При необходимости введения 1/2 дозы (0,25 мл из шприца, содержащего 0,5 мл препарата, удаляют половину содержимого, доведя поршень до соответствующей риски на шприце. Пациенту вводят оставшееся количество вакцины (0,25 мл).
Процедура использования шприца. снабженного устройством предохранительным для предварительно наполненных шприцев:
Во избежание срабатывания устройства предохранительного:
- шприц рекомендуется удерживать за устройство предохранительное, а не за поршень шприца или колпачок иглы, извлекая его из контурной ячейковой упаковки;
- перед введением препарата не тяните устройство предохранительное по направлению от пальцевых выступов устройства предохранительного к игле шприца;
- не пытайтесь активировать устройство предохранительное до проведения инъекции;
- не пытайтесь снять устройство предохранительное С предварительно наполненного шприца до проведения инъекции.
- перед проведением инъекции убеждаются, что устройство предохранительное на шприце находится во взведенном состоянии, не сработало случайно, Т.е. игла шприца в колпачке свободна и не закрыта устройством предохранительным;
- колпачок снимают с иглы шприца, осторожно потянув его с иглы без скручивания по направлению от шприца;
- место инъекции протирают 70-процентным спиртом;
- вакцину немедленно вводят пациенту. Для этого нажимают на поршень, крепко удерживая шприц, и вводят все его содержимое (1 доза). При необходимости введения 1/2 дозы (0,25 мл), из шприца, содержащего 0,5 мл препарата, удаляют половину содержимого, доведя поршень до соответствующей риски на шприце.
Пациенту вводят оставшееся количество вакцины (О 25 мл);
- после проведения инъекции активируют устройство предохранительное. Для этого устройство предохранительное тянут по направлению от пальцевых выступов к игле шприца на максимальное расстояние о наступления щелчка, что означает, что устройство предохранительное сработало. В этом случае игла шприца будет закрыта устройством предохранительным.
Побочное действие
Информация о нежелательных явлениях, приведенная ниже, получена из контролируемых клинических исследований и в процессе пострегистрационного применения препарата в Российской Федерации.
Данные клинических исследований
В контролируемых клинических исследования вакцина вводилась более чем 5000 вакцинируемым в возрасте от 18 и старше и 100 вакцинируемым в возрасте до 18 лет.
Нежелательные явления, представленные нижеперечисленны в соответствии с поражением органов и систем органов и частотой встречаемости. Частота встречаемости определяется следующим образом: очень часто (;>:1/10), часто (;>:1:100 и <1/10), нечасто (≥1:1000и <1:100), редко (≥1:10000 и <1:1000), очень редко <1:10000, включая отдельные случаи).
Нарушения со стороны нервной cucmемы: Нечасто: головная боль*
Нарушения со стороны кожи и подкожных тканей: Нечасто: повышенная потливость*
Нарушения со стороны костно-мышечной системы u соединительной ткани Нечасто: артралгия, миалгия*
Общие расстройства u реакции в месте введения: Часто: боль в месте инъекции.
Нечасто: повышение температуры, озноб, слабость.
* — нежелательные явления, которые регистрировались не во всех исследованиях.
Указанные нежелательные реакции развиваются в день вакцинации, обычно исчезают самостоятельно через 1-3 дня и не требуют лечения.
Данные пострегистрационного наблюдения
Спонтанные сообщения о нежелательных явлениях, отличающихся от указанных выше, при коммерческом применении препарата не поступали.
При появлении нежелательных явлений следует обратиться к врачу.
Передозировка
О случаях передозировки не сообщалось.
Взаимодействие с другими лекарственными средствами
Вакцина может при меняться одновременно с другими инактивированными вакцинами. При этом должны учитываться противопоказания к каждого из применяемых вакцин, препараты должны вводиться В разные участки тела разными шприцами. Вакцинация пациентов, получающих иммуносупрессивнvю терапию, может быть менее эффективной.
Особые указания
Не вводить внутривенно!
Перед прививкой вакцинируемые должны быть осмотрены врачом (фельдшером) с обязательным проведением термометрии. При температуре тела выше 37С вакцинацию не проводят.
Кабинеты, где проводится вакцинация, должны быть оснащены средствами противошоковой терапии. Вакцинированный должен находиться под наблюдением медработника в течение 30 мин после вакцинации
Использованные и неиспользованные ампулы, флаконы, шприцы, иглы утилизируют в соответствии с требованиями действующего законодательства.
Влияние на способность управлять транспортными средствами, механизмами. Исследования по изучению влияния вакцины на способность управлять транспортными средствами и механизмами не проводились.
Форма выпуска
Раствор для внутримышечного введения.
По 0,5 мл (1 доза) с консервантом или без консерванта в ампулах; по 0,5 мл (1 доза) без консерванта в шприцах с устройством предохранительным для предварительно наполненных шприцев или без него; по 0,5 мл (1 доза) без консерванта или 2,5 мл (5 доз) с консервантом во флаконах.
По 10 ампул в пачке из картона вместе с ножом ампульным или скарификатором и инструкцией по применению.
По 10 ампул в контурной ячейковой упаковке. По 1контурной ячейковой упаковке в пачке из картона вместе с ножом ампульным или скарификатором и инструкцией по применению.
При упаковке ампул с пережимом, имеющих кольцо или точку для вскрытия, нож ампульный или скарификатор не вкладывают.
По 1 шприцу в контурной ячейковой упаковке, покрытой фольгой алюминиевой, бумагой упаковочной с полимерным покрытием или пленкой полимерной. По 1 или по 10 контурных ячейковых упаковок в пачке из картона вместе с инструкцией по применению.
По 1 шприцу с устройством предохранительным для предварительно наполненных шприцев в контурной ячейковой упаковке, покрытой фольгой алюминиевой, бумагой упаковочной с полимерным покрытием или пленкой полимерной. По 1 контурной ячейковой упаковке в пачке из картона вместе с инструкцией по применению.
По 1 флакону в пачке из картона вместе с инструкцией по применению.
По 10 флаконов (по 1 дозе) в пачке из картона вместе с инструкцией по применению.
На пачке препарата, не содержащего консервант, нанесена предупредительная надпись «Без консерванта».
Условия хранения
Хранить при температуре от 2 до 8С. Замораживание не допускается. Хранить в недоступном для детей месте.
Условия транспортирования. Транспортировать при температуре от 2 до 8С Замораживание не допускается.
Срок годности 1 год. Препарат с истекшим сроком годности применению не подлежит.
Условия отпуска
Отпускают по рецепту (упаковки по 1 шприцу или 1 флакону (по 1 дозе)). Для лечебно-профилактических учреждений упаковки по 10 ампул, 10 шприцев, 10 флаконов, или 1 флакону (5 доз)
Производитель
ООО «ФОРТ», Россия, 390540, Рязанская обл., Рязанский район, Окское с/п, 1з.
ФГУП СПбНИИВС ФМБА России, Россия, 198320. г. Санкт-Петербург, г. Красное Село, ул. Свободы, д. 52.
Производитель готовой лекарственной формы
ФГУП СПбНИИВС ФМБА России, Россия, 198320, г. Санкт-Петербург, г. Красное Село, ул. Свободы, д. 52.
Фасовщик (первичная упаковка/упаковщик (вторичная (потребительская) упаковка /выпускающий контроль качества
ООО «ФОРТ», Россия, 390540, Рязанская обл., Рязанский район, Окское с/п, 1з.
Владелец регистрационного удостоверения/организация, принимающая претензии потребителя
ООО «ФОРТ», Россия, 390540, Рязанская обл., Рязанский район, Окское с/п, Га, тел. (4912) 70-15-00, факс (4912) 70-15-01
Рекламации на качество препарата, а также о случаях повышенной реактогенности или развитии осложнений следуюет направлять в адрес 000 «ФОРТ» с указанием номера серии и даты выпуска препарата с последующим представлением медицинской документации.
Оставьте заявку на вакцинацию.
Наш менеджер согласует удобное для вас время приема.
- Patil H., Tiwari R. V., Repka M. A. Recent advancements in mucoadhesive floating drug delivery systems: A mini-review. Journal of Drug Delivery Science and Technology. 2016; 31: 65–71.DOI: 10.1016/j.jddst.2015.12.002.
- Скориченко, «Доисторическая M.» (СПб., 1996); его же, «Гигиена в доисторические времена» (СПб., 1996).
- Moustafine R. I., Bobyleva V. L., Bukhovets A. V., Garipova V. R.,Kabanova T. V., Kemenova V. A., Van den Mooter G. Structural transformations during swelling of polycomplex matrices based on countercharged (meth)acrylate copolymers (Eudragit® EPO/Eudragit® L 100-55). Journal of Pharmaceutical Sciences. 2011; 100:874–885. DOI:10.1002/jps.22320.
- https://medi.ru/instrukciya/ultrix-kvadri_16140/.
- https://www.rlsnet.ru/tn_index_id_47301.htm.
- https://www.nkkdc.ru/vaccination/vaccines/ultriks/.
- Baas, «Geschichte d. Medicin».